题目内容
5.设NA为阿伏伽德罗常数值.下列有关叙述正确的是( )| A. | 电解精炼粗铜(含有锌铁等杂质),若阳极溶解32g铜,转移电子数目为NA | |
| B. | 256gS8(分子结构如图)含S-S键数为7NA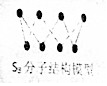 | |
| C. | 某温度下,pH=1的1LH2SO4溶液中含有的H+数目为0.1NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体时,负极消耗的气体分子数目为2NA |
分析 A.粗铜中含有杂质Zn,电解时Zn优先放电,则阳极溶解32gCu时,转移电子大于0.5mol;
B.一个S8分子中含8个S-S键,据此计算出256g晶体中含有的S-S的数目;
C.pH=1的溶液中氢离子浓度为0.1mol/L,根据n=cV计算出氢离子的物质的量即可;
D.没有告诉在标准状况下,无法计算正极气体的物质的量.
解答 解:A.电解精炼铜时,阳极是粗铜,粗铜中含有一些比铜活泼的金属也放电,阳极的铜溶解32g时,注意电子的物质的量大于:$\frac{32g}{64g/mol}$×2=1mol,转移电子数目大于NA,故A错误;
B.256g S8晶体含有S8的物质的量为:$\frac{256g}{256g/mol}$=1mol,1molS8中含有8mol S-S键,含有的S-S键为8NA个,故B错误;
C.pH=1的1LH2SO4溶液中氢离子的物质的量为:0.1mol/L×1L=0.1mol,含有的H+数目为0.1NA,故C正确;
D.不是标准状况下,不能使用标准状况下的气体摩尔体积计算,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的计算及判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.甲酸中含有醛基与羧基两种官能团,是一种特殊的酸,它与溴水可以发生如下反应:Br2(aq)+HCOOH(aq)→2HBr(aq)+CO2(g).生成CO2的初始速率与反应物起始浓度关系如下表:
现将0.02mol•L-1溴水和0.02mol•L-1 HCOOH溶液等体积混合,此时生成CO2的初始速率(单位:mol•L-1•s-1)应为( )
| 实验序号 | 起始浓度 | CO2(g)起始速率/mol•L-1•S-1 | |
| c(Br2) | c(HCOOH) | ||
| 1 | 0.01 | 0.02 | 2.0×10-6 |
| 2 | 0.02 | 0.04 | 8.0×10-6 |
| 3 | 0.03 | 0.02 | 6.0×10-6 |
| A. | 1.0×10-6 | B. | 1.0×10-7 | C. | 4.0×10-6 | D. | 5.0×10-7 |
16.关于恒容密闭容器进行的反应C(s)+CO2(g)?2CO(g)△H>0.下列说怯不正确的是( )
| A. | △s>0 | |
| B. | 在低温下能自发进行 | |
| C. | 当混合气体的密度不再变化时.反应达到平衡 | |
| D. | 达到平衡时,升高温度,CO2的转化率和反应速率均增大 |
13.足量下列溶液与相同质量的铝反应放出氢气,消耗溶质物质的量最少的是( )
| A. | NaOH溶液 | B. | 稀硫酸 | C. | 盐酸 | D. | Ba(OH)2溶液 |
20.下列关于氯水的叙述,正确的是( )
| A. | 氯水中起漂白作用的是氯气分子 | |
| B. | 向氯水中加入NaHCO3粉末,无明显现象 | |
| C. | 与久置氯水不同,在新制氯水中加入硝酸银溶液后无白色沉淀 | |
| D. | 新制的氯水可使有色布条、品红溶液、石蕊试液等褪色 |
10.已知298K时,CO2(g)的△H为-393.5kJ•mol-1,H2O(l)的△H=-285.8kJ•mol-1,乙炔的燃烧热为-1300kJ•mol-1,则乙炔的标准生成热为( )
| A. | 227.2kJ•mol-1 | B. | -227.2kJ•mol-1 | C. | 798.8kJ•mol-1 | D. | -798.8kJ•mol-1 |
17.25℃时,对于浓度均为0.1mol/L的三种溶液:①CH3COOH溶液、②NaOH溶液、③CH3COONa溶液,下列说法错误的是( )
| A. | ①和②等体积混合后的溶液中:c(OH-)═c(H+)+c(CH3COOH) | |
| B. | ①和③等体积混合后溶液显酸性:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | ②和③等体积混合后溶液中由水电离出的c(H+)<10-7 mol/L | |
| D. | 由水电离出的c(OH-):②>③>① |
14.能影响水的电离平衡,并使溶液中的[H+]>[OH-]的操作是( )
| A. | 向水中加入醋酸钠 | B. | 将水加热煮沸 | ||
| C. | 向水中加入硫酸氢钠 | D. | 向水中加食盐晶体 |