题目内容
17.25℃时,对于浓度均为0.1mol/L的三种溶液:①CH3COOH溶液、②NaOH溶液、③CH3COONa溶液,下列说法错误的是( )| A. | ①和②等体积混合后的溶液中:c(OH-)═c(H+)+c(CH3COOH) | |
| B. | ①和③等体积混合后溶液显酸性:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | ②和③等体积混合后溶液中由水电离出的c(H+)<10-7 mol/L | |
| D. | 由水电离出的c(OH-):②>③>① |
分析 A.①和②等体积混合后恰好生成醋酸钠,根据质子守恒判断;
B.①和③等体积混合后溶液显酸性,说明醋酸的电离程度大于醋酸根离子的水解程度;
C.②和③等体积混合后溶液呈碱性,氢氧化钠电离出的氢氧根离子抑制了水的电离;
D.醋酸和氢氧化钠溶液都抑制了水的电离,醋酸根离子水解促进了水的电离.
解答 解:A.①和②等体积混合后恰好生成醋酸钠,根据质子守恒可得:c(OH-)=c(H+)+c(CH3COOH),故A正确;
B.①和③等体积混合后溶液显酸性,说明CH3COOH的电离程度大于CH3COO-的水解程度,则溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B正确;
C.②和③等体积混合后呈碱性,氢氧化钠抑制了水的电离,则溶液中由水电离出的c(H+)<10-7 mol/L,故C正确;
D.①CH3COOH溶液抑制了水的电离,②NaOH溶液抑制了水的电离,由于醋酸为弱酸,氢氧化钠为强碱,则②对水电离的抑制程度大于①;③CH3COONa溶液中醋酸根离子水解促进了水的电离,则③中水的电离程度最大,
根据分析可知,由水电离出的c(OH-)大小为:③>①>②,故D错误;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确水的电离及其影响、盐的水解原理为解答关键,注意掌握电荷守恒、质子守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
7.已知汽车尾气无害化处理反应为2NO(g)+2CO(g)?N2(g)+2CO2(g),下列说法中不正确的是( )
| A. | NO的消耗速率等于CO2的生成速率时,反应不一定达到平衡 | |
| B. | CO的消耗速率是N2消耗速率的两倍时达到平衡 | |
| C. | 反应达到平衡后,NO的浓度等于CO2的浓度 | |
| D. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
8.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,64g SO2气体中所含分子数为NA | |
| B. | 标准状况下,4.48L四氯化碳中所含原子总数为NA | |
| C. | 1mol HNO3作氧化剂时转移电子数为3NA | |
| D. | 常温常压下,11.2L NO2中所含分子数为0.5NA |
5.设NA为阿伏伽德罗常数值.下列有关叙述正确的是( )
| A. | 电解精炼粗铜(含有锌铁等杂质),若阳极溶解32g铜,转移电子数目为NA | |
| B. | 256gS8(分子结构如图)含S-S键数为7NA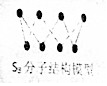 | |
| C. | 某温度下,pH=1的1LH2SO4溶液中含有的H+数目为0.1NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体时,负极消耗的气体分子数目为2NA |
2.甲物质与强碱溶液反应只生成盐和水,甲一定不属于( )
| A. | 酸 | B. | 盐 | C. | 金属单质 | D. | 氧化物 |
9.在水溶液中能大量共存的一组离子是( )
| A. | NH4+、K+、Br-、Cl- | B. | Na+、Cu2+、OH-、SO42- | ||
| C. | Mg2+、H+、CH3COO-、SO42- | D. | HCO3-、NO3-、OH-、Na+ |
15.已知一些燃料的燃烧热数据如表:
使用上述燃料,最能体现“低碳经济”理念的是( )
| 燃料 | 甲醇 | 丙烷 | 乙烷 | 乙烯 |
| △H/kJ•mol-1 | -726.0 | -2220.0 | -1560.0 | -1410.0 |
| A. | 甲醇 | B. | 丙烷 | C. | 乙烷 | D. | 乙烯 |
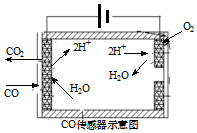 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.


