题目内容
14.能影响水的电离平衡,并使溶液中的[H+]>[OH-]的操作是( )| A. | 向水中加入醋酸钠 | B. | 将水加热煮沸 | ||
| C. | 向水中加入硫酸氢钠 | D. | 向水中加食盐晶体 |
分析 c(H+)>c(OH-),溶液呈酸性,再根据影响水的电离的因素:温度、同离子效应、所加物质的酸碱性等具体分析水的电离平衡的移动.
解答 解:A、由于醋酸钠是强碱弱酸盐,水解显碱性,故加入醋酸钠后溶液中的[H+]<[OH-],故A错误;
B、将水煮沸,水的电离被促进,但仍显中性,即[H+]=[OH-],故B错误;
C、加入硫酸氢钠后,硫酸氢钠能完全电离为钠离子、氢离子和硫酸根,使溶液显酸性,故[H+]>[OH-],且电离出的氢离子对水的电离有抑制作用,故C正确;
D、加入的氯化钠是强酸强碱盐,对水的电离无影响,且溶液显中性,即[H+]=[OH-],故D错误.
故选C.
点评 本题主要考查学生对水的电离的影响因素的判断,酸与碱均抑制水的电离,可以根据所学知识进行回答,较简单.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
5.设NA为阿伏伽德罗常数值.下列有关叙述正确的是( )
| A. | 电解精炼粗铜(含有锌铁等杂质),若阳极溶解32g铜,转移电子数目为NA | |
| B. | 256gS8(分子结构如图)含S-S键数为7NA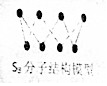 | |
| C. | 某温度下,pH=1的1LH2SO4溶液中含有的H+数目为0.1NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体时,负极消耗的气体分子数目为2NA |
2.甲物质与强碱溶液反应只生成盐和水,甲一定不属于( )
| A. | 酸 | B. | 盐 | C. | 金属单质 | D. | 氧化物 |
9.在水溶液中能大量共存的一组离子是( )
| A. | NH4+、K+、Br-、Cl- | B. | Na+、Cu2+、OH-、SO42- | ||
| C. | Mg2+、H+、CH3COO-、SO42- | D. | HCO3-、NO3-、OH-、Na+ |
19.下列试剂保存方法正确的是( )
| A. | 氯水保存在棕色试剂瓶中 | |
| B. | 氢氧化钠溶液保存在带有玻璃塞的玻璃试剂瓶中 | |
| C. | 金属钠保存在水中 | |
| D. | 氢氟酸保存在玻璃试剂瓶中 |



