题目内容
8.人在做过剧烈运动后,有一段时间腿和胳膊感到有酸胀或疼痛的感觉.原因之一是:C6H12O6(葡萄糖)$\stackrel{酶}{→}$2C3H6O3(乳酸).在浓硫酸存在下,乳酸可发生如下图所示的反应.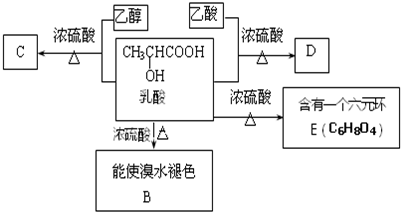
请回答下列问题:
(1)乳酸分子中含有的官能团是羧基、羟基;(写名称)
(2)乳酸→D的反应类型是酯化反应;
(3)写出结构简式:BCH2=CHCOOH; D
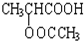 ;
;(4)写出化学方程式:乳酸→C
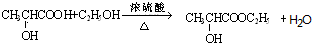 ;
;(5)90g乳酸与足量金属钠完全反应产生的气体在标准状况下的体积是22.4L.
分析 乳酸与乙醇发生酯化反应得到C为 ,乳酸与乙酸发生酯化反应得到D为
,乳酸与乙酸发生酯化反应得到D为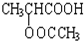 ,乳酸发生消去反应生成B为CH2=CHCOOH,2分子乳酸发生酯化反应形成环酯E为
,乳酸发生消去反应生成B为CH2=CHCOOH,2分子乳酸发生酯化反应形成环酯E为 .
.
解答 解:乳酸与乙醇发生酯化反应得到C为 ,乳酸与乙酸发生酯化反应得到D为
,乳酸与乙酸发生酯化反应得到D为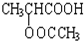 ,乳酸发生消去反应生成B为CH2=CHCOOH,2分子乳酸发生酯化反应形成环酯E为
,乳酸发生消去反应生成B为CH2=CHCOOH,2分子乳酸发生酯化反应形成环酯E为 .
.
(1)乳酸分子中含有的官能团是:羧基、羟基,故答案为:羧基、羟基;
(2)乳酸→D的反应类型是:酯化反应,故答案为:酯化反应;
(3)B的结构简式为CH2=CHCOOH,D的结构简式为: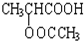 ,故答案为:CH2=CHCOOH;
,故答案为:CH2=CHCOOH;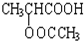 ;
;
(4)乳酸→C的化学方程式为: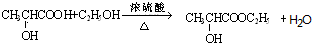 ,
,
故答案为: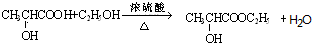 ;
;
(5)90g乳酸的物质的量为$\frac{90g}{90g/mol}$=1mol,羟基、羧基均与金属钠完全反应生成氢气,标况下生成氢气体积为:1mol×22.4L/mol=22.4L,故答案为:22.4.
点评 本题考查有机物推断,涉及醇、羧酸、酯之间的转化关系等,难度不大,熟练掌握官能团的性质与转化.

练习册系列答案
相关题目
18.有机物与生产、生活密切相关.下列说法不正确的是( )
| A. | 变质的油脂有特殊难闻气味,是因为油脂发生了氧化反应 | |
| B. | 棉花的主要成分是淀粉 | |
| C. | 酒精类饮料中含有乙醇 | |
| D. | 牛奶中含有蛋白质 |
19.下列关于元素周期表的说法正确的是( )
| A. | ⅠA族元素也称为碱金属元素 | |
| B. | 稀有气体元素原子的最外层电子数均为8 | |
| C. | 元素周期表中最右上角元素的非金属性最强 | |
| D. | 元素周期表有18个纵行,16个族 |
3.已知: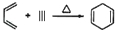 ,如果要合成
,如果要合成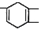 ,所用的起始原料可以是( )
,所用的起始原料可以是( )
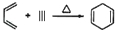 ,如果要合成
,如果要合成 ,所用的起始原料可以是( )
,所用的起始原料可以是( )| A. | CH2=C(CH3)CH=CH2和CH≡C-CH2CH3 | B. | CH2=CHCH=CHCH3和CH3C≡CCH3 | ||
| C. | CH2=C(CH3)C(CH3)=CHCH3和CH≡CH | D. | CH2=C(CH3) C(CH3)=CH2和CH3C≡CH |
13.MnO2和锌是制造干电池的主要原料.
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解.
90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌.简化流程框图如下(中间产物的固体部分已经略去):
 已知各种金属离子完全沉淀的pH如下表:
已知各种金属离子完全沉淀的pH如下表:
回答下列问题:
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+
此空删去,另外一种固体物质可为Zn(OH)2.
(4)步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+.产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用.
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解.
90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌.简化流程框图如下(中间产物的固体部分已经略去):
 已知各种金属离子完全沉淀的pH如下表:
已知各种金属离子完全沉淀的pH如下表:| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+
此空删去,另外一种固体物质可为Zn(OH)2.
(4)步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+.产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用.
20.重水(D2O)是重要的核工业原料,下列说法正确的是( )
| A. | 氘(D)的原子核外有2个电子 | |
| B. | 1H与D是同一种原子 | |
| C. | H2O与D2O互称同素异形体 | |
| D. | 1H${\;}_{2}^{18}$O与D${\;}_{2}^{16}$O的相对分子质量相同 |
17.NH3是一种重要的化工产品,是氮肥工业和制造硝酸、铵盐的重要原料: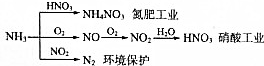
下列有关叙述错误的是( )
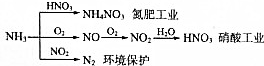
下列有关叙述错误的是( )
| A. | NH4NO3是常用化肥,在农业上用作棉花、亚麻、大麻、烟草和蔬菜等农作物的肥料,效果特别好 | |
| B. | 硝酸工业中氮元素的化合价变化情况:-3→+2→+4→+5 | |
| C. | NH3和NO2在一定条件下发生氧化还原反应,其化学方程式:8NH3+6NO2$\frac{\underline{催化剂}}{△}$7N2+12H20 | |
| D. | NH3在氮肥工业中氮元素被还原,而在硝酸工业中氮元素被氧化 |