题目内容
8.在某温度下下,将7.1g硫酸钠固体(不含结晶水)溶解在一定量水中,配成500mL 溶液.求:(1)该溶液中硫酸钠的物质的量浓度;
(2)溶液中阴阳离子的总物质的量.
分析 结合n=$\frac{m}{M}$、c=$\frac{n}{V}$及物质构成计算.
解答 解:(1)n(Na2SO4)=$\frac{7.1g}{142g/mol}$=0.05mol,c(Na2SO4)=$\frac{0.05mol}{0.5L}$=0.1mol/L,
答:该溶液中硫酸钠的物质的量浓度为0.1mol/L;
(2)由Na2SO4=2Na++SO42-,溶液中阴阳离子的总物质的量为0.05mol+0.05mol×2=0.15mol,
答:溶液中阴阳离子的总物质的量为0.15mol.
点评 本题考查物质的量浓度的计算,为高频考点,把握物质的量、质量及浓度的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
16.将4.9g Mg和Fe的混合物在过量的稀硝酸中完全反应,得到标准状况下NO气体2.24L,向反应后的溶液中加入足量的烧碱充分反应,最后生成的沉淀的质量是( )
| A. | 8g | B. | 10g | C. | 10.2g | D. | 11.2g |
16.下列各溶液中,微粒的物质的量浓度关系表述正确的是( )
| A. | pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)相等 | |
| B. | 常温下,pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH<7 | |
| C. | 将0.2 mol•L-1NaA溶液和0.1 mol•L-1盐酸溶液等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-) | |
| D. | 0.1 mol•L-1 Na2CO3溶液中:c(Na+)=c(HCO${\;}_{3}^{-}$)+c(H2CO3)+2c(CO${\;}_{3}^{2-}$) |
3.某强酸性溶液中可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下实验:下列有关判断正确的是( )


| A. | 原溶液中一定有Fe2+、SO42-、H+、NH4+、Al3+ | |
| B. | 原溶液中一定没有Ba2+、CO32-、NO3- | |
| C. | 步骤③中反应的离子方程式为2AlO-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 气体A、B之间肯定不能发生反应 |
20. 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
(1)目前工业上有一种方法是用CO2和H2在230℃能量催化剂条件下转化生成甲醇蒸汽和水蒸气.如图表示恒压容器中0.5mol CO2和1.5mol H2转化率达80%时的能量变化示意图.能判断该反应达到化学平衡状态的依据是bd(填字母).
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①实验2条件下平衡常数K=.
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b的值(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时v(正)<v(逆)(填“<’’、“>”或“=’’).
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性.常温下,向10mL 0.0l mol.L-l H2C2O4溶液中滴加10mL 0.01mol.L-l NaOH溶液时,比较溶液中各种离子浓度的大小关系c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
(5)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式
为CH3OCH3+16OH--12e-=2CO32-+11H2O.
 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.(1)目前工业上有一种方法是用CO2和H2在230℃能量催化剂条件下转化生成甲醇蒸汽和水蒸气.如图表示恒压容器中0.5mol CO2和1.5mol H2转化率达80%时的能量变化示意图.能判断该反应达到化学平衡状态的依据是bd(填字母).
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度 ℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b的值(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时v(正)<v(逆)(填“<’’、“>”或“=’’).
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性.常温下,向10mL 0.0l mol.L-l H2C2O4溶液中滴加10mL 0.01mol.L-l NaOH溶液时,比较溶液中各种离子浓度的大小关系c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
(5)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式
为CH3OCH3+16OH--12e-=2CO32-+11H2O.
17.化学与工农业生产、人类生活密切相关.下列说法中不正确的是( )
| A. | 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔 | |
| B. | 喝补铁剂时,加服维生素C,效果更好,原因是维生素C具有氧化性 | |
| C. | 食用花生油和鸡蛋清都能发生水解反应 | |
| D. | “地沟油”经加工处理后,可用于生产肥皂和生物柴油 |
18.用下列三种装置制备和收集CO2:将收集到的三瓶CO2分别置于天平上称量,若三个集气瓶体积相同、质量相等,则称量结果( )
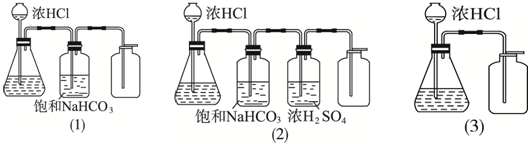

| A. | (1)(2)(3)一样重 | B. | (1)中最重 | C. | (2)中最重 | D. | (3)最轻 |
 .
. .
. .
.