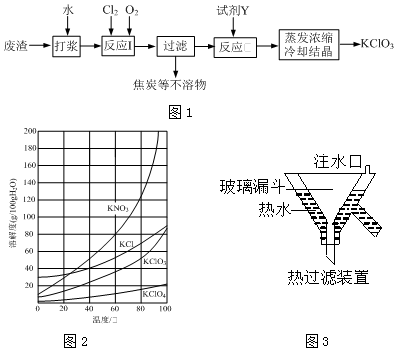
题目内容
2.如图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液.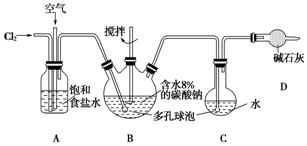
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8℃,42℃以上分解为Cl2和O2.
(1)①实验中控制氯气与空气的体积比的方法是通过观察A中产生气泡的速率调节流速.
②使用多孔球泡的作用是增加气体与溶液的接触面积,使反应充分进行.
(2)①装置B中产生Cl2O的化学方程式为2Cl2+Na2CO3═Cl2O+2NaCl+CO2.
②若B无冷却装置,进入C中的Cl2O会大量减少.其原因是该反应放热,温度升高Cl2O会分解.
(3)装置C中采用棕色圆底烧瓶是因为HClO见光易分解.
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-.测定C中所得次氯酸溶液的物质的量浓度的实验方案:用酸式滴定管或移液管量取20.00mL次氯酸溶液于烧杯中,加入足量的H2O2溶液,再加入足量的AgNO3溶液,过滤,洗涤,在真空干燥箱中干燥,用电子天平称量沉淀质量.(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液.除常用仪器外须使用的仪器有:电子天平,真空干燥箱)
分析 氯气通过A装置与空气形成1:3的混合气体通入B装置,在搅拌棒的作用下与含水8%的碳酸钠充分反应制备Cl2O,并用水吸收Cl2O制备次氯酸溶液,同时用碱石灰吸收含有Cl2O的尾气,防止污染环境,
(1)①通过观察A中产生气泡的比例来调节气体的流速可以控制氯气与空气体积比的方法;
②多孔球泡增加气体与溶液的接触面积可以加快反应速率;
(2)①装置B中,氯氯气和碳酸钠反应生成Cl2O;
②由于该反应为放热反应,温度升高Cl2O会分解,故进入C中的Cl2O会大量减少,
故答案为:该反应放热,温度升高Cl2O会分解;
(3)装置C是用水吸收Cl2O制备次氯酸溶液,但生成的HClO见光易分解,反应装置须选择避光;
(4)次氯酸溶液既有酸性,又有强氧化性,应选用酸式滴定管或移液管;实验原理是结合所提供的试剂H2O2是还原HClO生成Cl-,再滴加过量提供的硝酸银溶液,根据生成的AgCl沉淀质量计算原溶液HClO的浓度.
解答 解:(1)①通过观察A中产生气泡的比例来调节气体的流速可以控制氯气与空气体积比的方法;
故答案为:通过观察A中产生气泡的速率调节流速;
②多孔球泡增加气体与溶液的接触面积可以加快反应速率;
故答案为:增加气体与溶液的接触面积,使反应充分进行;
(2)①装置B中,氯氯气和碳酸钠反应生成Cl2O,化学方程式为:2Cl2+Na2CO3═Cl2O+2NaCl+CO2;
故答案为:2Cl2+Na2CO3═Cl2O+2NaCl+CO2;
②由于该反应为放热反应,温度升高Cl2O会分解,故进入C中的Cl2O会大量减少;
故答案为:该反应放热,温度升高Cl2O会分解;
(3)水吸收Cl2O制备次氯酸溶液,HClO见光易分解,故装置C中采用棕色圆底烧瓶;
故答案为:HClO见光易分解;
(4)次氯酸溶液既有酸性,又有强氧化性,应选用酸式滴定管或移液管;具体实验操作是,向20.00mL的次氯酸溶液里加入足量的H2O2溶液,再加入足量的AgNO3溶液,过滤、洗涤,在真空干燥箱中干燥沉淀,用电子天平称量沉淀的质量;
故答案为:酸式滴定管或移液管;加入足量的H2O2溶液,再加入足量的AgNO3溶液,过滤,洗涤,在真空干燥箱中干燥,用电子天平称量沉淀质量.
点评 本题考查了物质制备方案设计,主要考查了化学方程式的书写、实验方案评价、氧化还原反应、环境保护等,题目难度中等,侧重于考查学生的分析问题和解决问题的能量,注意相关基础知识的学习与积累.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案| A. |  图是除去水中泥沙 | B. |  图是配制0.100 mol/L稀硫酸 | ||
| C. |  图是点燃酒精灯 | D. |  图是检查装置的气密性 |
| A. | SiH4比CH4稳定 | |
| B. | P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱 | |
| C. | Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强 | |
| D. | O2-半径比F-的小 |
| A. | ⅡA和ⅦA | B. | ⅤA和ⅥA | C. | ⅥA和ⅥA | D. | ⅠA和ⅥA |
| A. | 17g NH3含有电子数为10NA | |
| B. | 标况下,4.48LH2O中所含的分子数是0.2NA | |
| C. | 0.1mol/L的K2SO4溶液中,K+的数目为0.2NA | |
| D. | 30 g乙烷(C2H6)所含的原子数目为NA |
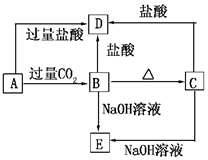 A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃).
A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃).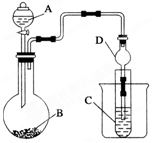 为探究元素的非金属性的变化规律,某化学兴趣小组同学设计了如下一系列实验,利用如图所示装置:
为探究元素的非金属性的变化规律,某化学兴趣小组同学设计了如下一系列实验,利用如图所示装置: