题目内容
3.为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)称取粗盐$\stackrel{①}{→}$ $→_{②}^{BaCl_{2}}$ $→_{③}^{NaOH}$ $→_{④}^{Na_{2}CO_{3}}$ $\stackrel{⑤}{→}$滤液$→_{⑥}^{适量盐酸}$ $→_{⑦}^{蒸发、结晶、烘干}$ 粗盐 第①步的操作是溶解,第⑤步的操作是过滤.
分析 除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,步骤为:称取粗盐$\stackrel{溶解}{→}$ $→_{②}^{BaCl_{2}}$ $→_{③}^{NaOH}$ $→_{④}^{Na_{2}CO_{3}}$ $\stackrel{过滤}{→}$滤液$→_{⑥}^{适量盐酸}$ $→_{⑦}^{蒸发、结晶、烘干}$ 粗盐(用于沉淀的试剂稍过量),以此来解答.
解答 解:除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,由步骤可知,粗盐溶于水后,用氯化钡除去硫酸根离子、用氢氧化钠除去镁离子、用碳酸钠除去钙离子,由于加入的氯化钡试剂是过量的,则为了除去过量的钡离子,则碳酸钠应该放在氯化钡溶液之后,将沉淀过滤后用盐酸中和,再蒸发结晶至有大量晶体析出、少量液体剩余时停止加热即可,则第①步的操作是溶解,第⑤步的操作是为过滤,
故答案为:溶解;过滤.
点评 本题考查混合物分离提纯,为高频考点,把握粗盐提纯步骤、混合物分离提纯方法为解答的关键,侧重分析与应用能力考查,注意实验基本操作,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.实验室用已知浓度的盐酸滴定未知浓度的NaOH溶液,下列操作会使所测NaOH浓度偏低的是( )
| A. | 滴定前,未用NaOH溶液对锥形瓶进行润洗 | |
| B. | 滴定过程中,有少量盐酸滴在锥形瓶外 | |
| C. | 盛装盐酸前,未对酸式滴定管进行润洗 | |
| D. | 滴定终点时,对酸式滴定管俯视读数 |
14.在测定硫酸铜晶体结晶水含量的实验中,会导致测定结果偏低的是( )
| A. | 加热后固体发黑 | B. | 坩埚沾有受热不分解的杂质 | ||
| C. | 加热时有少量晶体溅出 | D. | 晶体中混有受热不分解的杂质 |
11.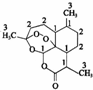 我国药学家屠呦呦教授因发现并提纯青蒿素而获得2015 年诺贝尔奖.青蒿素是用于治疗疟疾的药物,其结构简式如图:下列有关青蒿素的叙述正确的是( )
我国药学家屠呦呦教授因发现并提纯青蒿素而获得2015 年诺贝尔奖.青蒿素是用于治疗疟疾的药物,其结构简式如图:下列有关青蒿素的叙述正确的是( )
 我国药学家屠呦呦教授因发现并提纯青蒿素而获得2015 年诺贝尔奖.青蒿素是用于治疗疟疾的药物,其结构简式如图:下列有关青蒿素的叙述正确的是( )
我国药学家屠呦呦教授因发现并提纯青蒿素而获得2015 年诺贝尔奖.青蒿素是用于治疗疟疾的药物,其结构简式如图:下列有关青蒿素的叙述正确的是( )| A. | 分子式为 C15H2205 | B. | 有较强的还原性,能杀死疟原虫 | ||
| C. | 易溶于水、酒精等溶剂 | D. | 能发生取代反应和加成反应 |
8.下列分子中,既含有极性键又含有非极性键而且是非极性分子的是( )
| A. | CO2 | B. | CH4 | C. | C2H4 | D. | C2H5Cl |
15.已知某酸的酸式盐NaHY的水溶液的pH=6,则下列说法中正确的是( )
| A. | 相同物质的量浓度的Na2Y和NaHY溶液,前者的pH大于后者 | |
| B. | NaHY的溶液中,离子浓度大小顺序为:c(Na+)>c(Y-)>c(HY-)>c(OH-)>c(H+) | |
| C. | HY-的水解离子方程式为:HY-+H2O?Y-+H3O+ | |
| D. | 在Na2Y、NaHY、H2Y的溶液中,阴离子的种类不同 |
12.我国宋代《梦溪笔谈》中记叙了胆矾和铜的炼制过程:“信州铅山县有苦泉,煮之则得胆矾.熬胆矾铁釜,久之亦化为铜.”该炼制过程中没有涉及到的变化是( )
| A. | 复分解反应 | B. | 离子反应 | C. | 置换反应 | D. | 蒸发结晶 |
13.下列说法不正确的是( )
| A. | ⅠA元素的电负性从上到下逐渐增大,而ⅦA元素的电负性从上到下逐渐减小 | |
| B. | 电负性的大小可以作为衡量元素的金属性和非金属性强弱的尺度 | |
| C. | 氢原子中只有一个电子,故氢原子只有一个原子轨道 | |
| D. | NaH的存在能支持可将氢元素放在ⅦA的观点 |

 .
.