题目内容
4.钛(Ti)被誉为“21世纪的金属”.工业上将TiO2与焦炭混合,通入Cl2高温下制得TiCl4;再将TiCl4提纯后,在氩气保护下与镁高温反应制得Ti.其反应如下:①TiO2+2Cl2+2C$\frac{\underline{\;1173K\;}}{\;}$TiCl4+2CO ②TiCl4+2Mg$\frac{\underline{\;1220~1420K\;}}{\;}$Ti+2MgCl2
回答下列问题:
(1)氧原子外有5种不同空间运动状态的电子,写出两种与CO 互为等电子体的分子N2、C2H2.
(2)已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃;TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体.
①TiCl4为共价化合物(填“离子”或“共价”).
②TiCl4分子为正四面体形,则Ti为sp3杂化.
③TiCl4在潮湿空气中水解的化学方程式是TiCl4+3H2O=H2TiO3↓+4HCl.
④Mg与Al的第一电离能较小是Al.
(3)0.1mol配合物[TiCl(H2O)5]Cl2与足量AgNO3溶液反应生成AgCl质量为28.7g.
分析 (1)根据O原子的电子排布式分析;等电子体中价电子数相同;
(2)①根据题目中提供的物理性质来判断晶体类型从而判断化合物类型;
②可根据分子的构型来判断碳的杂化方式,四面体形属于sp3杂化,平面形中的碳属于sp2杂化,直线形中的碳属于sp杂化;
③TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体,据此写出方程;
④Mg的最外层电子处于全满状态,第一电离能大于同周期相邻元素;
(3)0.1mol配合物[TiCl(H2O)5]Cl2能电离出0.2mol氯离子,与足量AgNO3溶液反应生成0.2molAgCl,据此计算.
解答 解:(1)O原子的电子排布式为1s22s22p4,电子占据了5个轨道,所以有5种不同空间运动状态的电子;等电子体中价电子数都相同,则 N2、CN-、CO、C2H2的价电子数都是10,则互为等电子体;
故答案为:5;N2、C2H2;
(2)①已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃;,由此可判断 TiCl4是由共价键结合的分子;
故答案为:共价;
②TiCl4分子为正四面体形,Ti和Cl形成4个δ键,所以Ti为sp3杂化,
故答案为:sp3;
③TiCl4在潮湿空气中易水解产生白雾说明生成HCl,同时产生H2TiO3固体,所以其反应方程式为:TiCl4+3H2O=H2TiO3↓+4HCl,
故答案为:TiCl4+3H2O=H2TiO3↓+4HCl;
④Mg的最外层电子处于全满状态,第一电离能大于同周期相邻元素,所以第一电离能:Mg>Al,则第一电离能较小是Al;
故答案为:Al;
(3)0.1mol配合物[TiCl(H2O)5]Cl2能电离出0.2mol氯离子,与足量AgNO3溶液反应生成0.2molAgCl,则AgCl沉淀的质量为0.2mol×143.5g/mol=
28.7g;
故答案为:28.7g.
点评 本题考查了电子排布式、等电子体、杂化类型的判断、配合物的组成等知识.这些都是高考的热点,是物质结构和性质的重要内容,应熟练掌握,侧重于考查学生的分析能力和对基础知识的应用能力,题目难度中等.

| A. | 加热后固体发黑 | B. | 坩埚沾有受热不分解的杂质 | ||
| C. | 加热时有少量晶体溅出 | D. | 晶体中混有受热不分解的杂质 |
| A. | 相同物质的量浓度的Na2Y和NaHY溶液,前者的pH大于后者 | |
| B. | NaHY的溶液中,离子浓度大小顺序为:c(Na+)>c(Y-)>c(HY-)>c(OH-)>c(H+) | |
| C. | HY-的水解离子方程式为:HY-+H2O?Y-+H3O+ | |
| D. | 在Na2Y、NaHY、H2Y的溶液中,阴离子的种类不同 |
| A. | 复分解反应 | B. | 离子反应 | C. | 置换反应 | D. | 蒸发结晶 |
| A. | ⅠA元素的电负性从上到下逐渐增大,而ⅦA元素的电负性从上到下逐渐减小 | |
| B. | 电负性的大小可以作为衡量元素的金属性和非金属性强弱的尺度 | |
| C. | 氢原子中只有一个电子,故氢原子只有一个原子轨道 | |
| D. | NaH的存在能支持可将氢元素放在ⅦA的观点 |
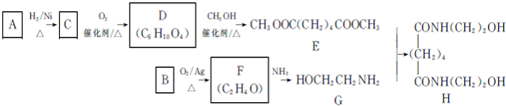
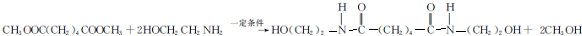 .
.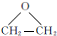 ,能发生银镜反应的F的同分异构体是CH3CHO.
,能发生银镜反应的F的同分异构体是CH3CHO.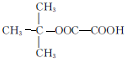 (写结构简式).
(写结构简式).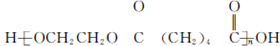 的合成路线:
的合成路线: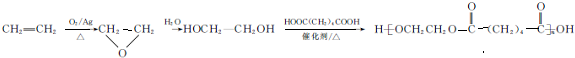 .
. ,名称为2,3-二甲基-2-丁烯.A中的碳原子是否都处于同一平面?是(填“是”或“不是”).
,名称为2,3-二甲基-2-丁烯.A中的碳原子是否都处于同一平面?是(填“是”或“不是”).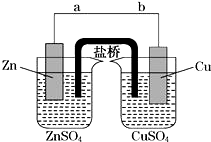 某学生利用如图实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64).按照实验步骤依次回答下列问题:
某学生利用如图实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64).按照实验步骤依次回答下列问题: