题目内容
16.纯碱和小苏打都是在日常生活中常用的白色晶体,若要在家中将它们区分开来,下列的方法中可行的是( )| A. | 分别放在炒锅中加热,观察是否有残留物 | |
| B. | 分别用干净铁丝蘸取样品在燃气炉的火焰上灼烧,观察火焰颜色 | |
| C. | 在水杯中各盛少许相同质量的样品,分别加入足量的水,观察样品是否溶解 | |
| D. | 在水杯中各盛少许相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度 |
分析 A.碳酸氢钠受热分解生成碳酸钠;
B.焰色反应为元素性质;
C.依据碳酸钠和碳酸氢钠水溶性解答;
D.碳酸钠与醋酸反应先生成碳酸氢钠,碳酸氢钠再与醋酸反应生成二氧化碳.
解答 解:A.碳酸氢钠受热分解生成碳酸钠,碳酸钠性质稳定,所以纯碱和小苏打分别放在炒锅中加热,都会有残留物,不能区分二者,故A不选;
B.碳酸钠和碳酸氢钠都含有钠元素,灼烧都产生黄色火焰,不能区分二者,故B错误;
C.碳酸钠和碳酸氢钠都易溶于水,所以不能区分二者,故C错误;
D.碳酸钠与醋酸反应先生成碳酸氢钠,碳酸氢钠再与醋酸反应生成二氧化碳,所以碳酸氢钠与醋酸反应剧烈,可以鉴别二者,故D正确;
故选:D.
点评 本题考查Na2CO3和NaHCO3性质的异同,题目难度不大,把握Na2CO3和NaHCO3性质是解题关键,题目难度不大.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
6.汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+xNa2O+16N2↑,下列说法错误的是( )
| A. | x=5 | |
| B. | 每生成16 mol N2转移10 mol电子 | |
| C. | N2既是氧化产物又是还原产物 | |
| D. | 反应中氧化产物与还原产物的质量之比为1:15 |
1.下列有关金属及其化合物的叙述中,不正确的是( )
| A. | 钠是一种银白色的固体,钠的质地软,可用小刀切割 | |
| B. | 钠的化学性质很活泼,钠元素在于自然界只有化合态,无游离态 | |
| C. | 氢氧化铝碱性很强,可用于治疗胃酸过多 | |
| D. | 明矾与水反应生成的Al(OH)3胶体可以吸附水中悬浮的杂质,使水澄清,所以明矾可以作净水剂 |
8.将铁粉中加入到一定量的CuSO4溶液中充分反应,若在反应过程中有0.2mol 电子发生转移,则反应结束后固体质量增加( )
| A. | 8g | B. | 0.8g | C. | 1.6g | D. | 16g |
5.下列化合物不能由单质直接合成的是( )
| A. | AlCl3 | B. | FeCl2 | C. | CuCl2 | D. | MgCl2 |
6.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 5.6 g铁与足量盐酸反应转移的电子数为0.3NA | |
| B. | 常温常压下,11.2L二氧化硫中含有的氧原子数为NA | |
| C. | 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA | |
| D. | 标准状况下,22.4 L氦气与22.4 L氮气所含原子数均为2 NA |
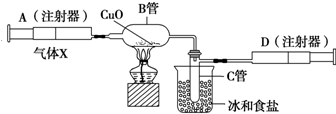 如图所示的实验装置可用来测定含两种元素的某种气体X的分子式.在注射器A中装有240mL气体X并慢慢通过不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到以下实验结果:实验前B管重20.32g,实验后B管重20.00g,B管中的黑色粉末变成红色粉末.在C管中收集到的无色液体是水;在注射器D中收集到的气体是氮气.试回答下列问题:
如图所示的实验装置可用来测定含两种元素的某种气体X的分子式.在注射器A中装有240mL气体X并慢慢通过不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到以下实验结果:实验前B管重20.32g,实验后B管重20.00g,B管中的黑色粉末变成红色粉末.在C管中收集到的无色液体是水;在注射器D中收集到的气体是氮气.试回答下列问题: