题目内容
1.下列有关金属及其化合物的叙述中,不正确的是( )| A. | 钠是一种银白色的固体,钠的质地软,可用小刀切割 | |
| B. | 钠的化学性质很活泼,钠元素在于自然界只有化合态,无游离态 | |
| C. | 氢氧化铝碱性很强,可用于治疗胃酸过多 | |
| D. | 明矾与水反应生成的Al(OH)3胶体可以吸附水中悬浮的杂质,使水澄清,所以明矾可以作净水剂 |
分析 A.钠是银白色金属固体,钠较软,易切割;
B.钠的化学性质很活泼,易和水、氧气反应;
C.氢氧化铝属于两性氢氧化物,具有弱碱性和弱酸性;
D.明矾水解生成氢氧化铝胶体,胶体具有吸附性,能吸附水中的悬浮物而净水.
解答 解:A.钠是银白色金属固体,钠的质地柔软,能用小刀切割,故A正确;
B.钠的化学性质很活泼,易和水、氧气反应,所以在自然界中钠不能以游离态存在,只有化合态,故B正确;
C.氢氧化铝属于两性氢氧化物,具有弱碱性和弱酸性,是两性氢氧化物,可用于治疗胃酸过多,故C错误;
D.明矾与水反应生成的Al(OH)3胶体,Al3++3H2O?Al(OH)3+3H+,胶体具有较大的表面积,可以吸附水中悬浮的杂质,使水澄清,所以明矾可以作净水剂,故D正确;
故选C.
点评 本题侧重考查学生对基础知识的掌握情况,题目难度不大,明确各种物质的性质和应用,理解相关概念是解题关键,注意相关知识的积累.

练习册系列答案
相关题目
12.将一定量的氯气通入30mol,浓度为10.00mol/L的氢氧化钠溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断正确的是( )
| A. | 若反应中转移的电子为n mol,则0.15<n<0.25 | |
| B. | n(Na+):n(Cl-) 可能为7:3 | |
| C. | 与NaOH反应的氯气一定为0.15 mol | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 |
9.下列物质的鉴别方法不正确的是( )
| A. | 用焰色反应鉴别NaCl、KCl和Na2SO4 | |
| B. | 用氢氧化钠溶液鉴别MgCl2溶液和AlCl3溶液 | |
| C. | 利用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | |
| D. | 用加热法鉴别Na2CO3和NaHCO3两种固体 |
16.纯碱和小苏打都是在日常生活中常用的白色晶体,若要在家中将它们区分开来,下列的方法中可行的是( )
| A. | 分别放在炒锅中加热,观察是否有残留物 | |
| B. | 分别用干净铁丝蘸取样品在燃气炉的火焰上灼烧,观察火焰颜色 | |
| C. | 在水杯中各盛少许相同质量的样品,分别加入足量的水,观察样品是否溶解 | |
| D. | 在水杯中各盛少许相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度 |
6.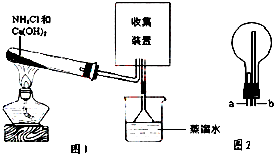 某化学兴趣小组同学用如图所示的实验装置制取氨气并探究氨气的性质,下列有关结论中不正确的是( )
某化学兴趣小组同学用如图所示的实验装置制取氨气并探究氨气的性质,下列有关结论中不正确的是( )
 某化学兴趣小组同学用如图所示的实验装置制取氨气并探究氨气的性质,下列有关结论中不正确的是( )
某化学兴趣小组同学用如图所示的实验装置制取氨气并探究氨气的性质,下列有关结论中不正确的是( )| A. | 图1试管中发生反应的化学方程式为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O | |
| B. | 向图1烧杯中滴加酚酞溶液,观察到溶液变红,说明氨水呈碱性 | |
| C. | 用图2装置收集氨气时,进气口是a | |
| D. | 图1中的三角漏斗能起到防止氨气倒吸的作用 |
11.A3+微粒核外有46个电子,质量数为115,则A原子核里的中子数是( )
| A. | 46 | B. | 66 | C. | 115 | D. | 49 |
 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:


