题目内容
8.将铁粉中加入到一定量的CuSO4溶液中充分反应,若在反应过程中有0.2mol 电子发生转移,则反应结束后固体质量增加( )| A. | 8g | B. | 0.8g | C. | 1.6g | D. | 16g |
分析 发生反应:Fe+CuSO4=Cu+FeSO4,根据电子转移计算参加Fe的物质的量、生成Cu的物质的量,生成Cu的质量与参加反应Fe的质量之差为固体质量增重.
解答 解:发生反应:Fe+CuSO4=Cu+FeSO4,反应中转移电子为0.2mol,则n(Fe)=n(Cu)=$\frac{0.2mol}{2}$=0.1mol,则固体质量增重为0.1mol×(64g/mol-56g/mol)=0.8g,
故选:B.
点评 本题考查化学方程式计算,比较基础,旨在考查学生基础知识的理解掌握.

练习册系列答案
相关题目
18.下列关于如图所示转化关系(X代表卤素)的说法错误的是( )
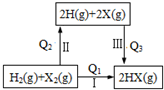

| A. | Q3>0 | B. | Q1=Q2+Q3 | ||
| C. | 按Cl、Br、I的顺序,Q2依次增大 | D. | Q1越大,HX越稳定 |
19.下列有关氧化物的说法正确的是( )
| A. | 碱性氧化物都是金属氧化物 | |
| B. | 酸性氧化物都是非金属氧化物 | |
| C. | NaO2能与酸反应生成盐和水,所以 NaO2是碱性氧化物 | |
| D. | SiO2 既能和氢氧化钠溶液反应又能和氢氟酸反应,所以是两性氧化物 |
16.纯碱和小苏打都是在日常生活中常用的白色晶体,若要在家中将它们区分开来,下列的方法中可行的是( )
| A. | 分别放在炒锅中加热,观察是否有残留物 | |
| B. | 分别用干净铁丝蘸取样品在燃气炉的火焰上灼烧,观察火焰颜色 | |
| C. | 在水杯中各盛少许相同质量的样品,分别加入足量的水,观察样品是否溶解 | |
| D. | 在水杯中各盛少许相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度 |
3.下列离子方程式书写正确的是( )
| A. | 铁片粉与稀硝酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 氧化亚铁粉末溶于盐酸中:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 铜与氯化铁溶液反应:2Fe3++Cu═2Fe2++Cu2+ | |
| D. | 向硫酸铝溶液中加入过量氨水:Al3++4OH-═AlO2+2H2O |
17.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸若a=7,则HA是强酸;若a>7,则HA是弱酸.
(2)不考虑其它组的实验结果,单从乙组情况分析,c是否一定等于0.2否(选填“是”或“否”),混合液中离子浓度c(A-)与 c(Na+)的大小关系是c(A-)=c(Na+).
(3)丙组实验结果分析,HA是弱酸(选填“强”或“弱”),该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=1×10-5mol•L-1.写出该丁组实验所得混合溶液中下列算式的精确结果(不能做近似计算).c(OH-)-c(HA)=1×10-9mol•L-1.
| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的 pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
(2)不考虑其它组的实验结果,单从乙组情况分析,c是否一定等于0.2否(选填“是”或“否”),混合液中离子浓度c(A-)与 c(Na+)的大小关系是c(A-)=c(Na+).
(3)丙组实验结果分析,HA是弱酸(选填“强”或“弱”),该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=1×10-5mol•L-1.写出该丁组实验所得混合溶液中下列算式的精确结果(不能做近似计算).c(OH-)-c(HA)=1×10-9mol•L-1.
18.下列物质中既能与稀硫酸反应,又能与氢氧化钠溶液反应是( )
①NaHCO3 ②Na2CO3 ③Al2O3 ④Al ⑤Al (OH)3.
①NaHCO3 ②Na2CO3 ③Al2O3 ④Al ⑤Al (OH)3.
| A. | ③④ | B. | ①③④⑤ | C. | ③④⑤ | D. | 全部 |



