题目内容
10.聚2-甲基-1-丙烯是生产汽油清洁剂(kerocom piba)的中间产物.下列关于聚异丁烯的说法中,错误的是( )| A. | 聚2-甲基-1-丙烯可以通过加聚反应制得 | |
| B. | 聚2-甲基-1-丙烯的分子式为 (C4H8)n | |
| C. | 聚2-甲基-1-丙烯完全燃烧生成CO2和H2O的物质的量相等 | |
| D. | 聚2-甲基-1-丙烯能使溴的四氯化碳溶液褪色 |
分析 聚异丁烯中不含碳碳双键,所以没有烯烃的性质,可以由异丁烯发生加聚反应生成聚异丁烯,据此分析解答.
解答 解:A.聚2-甲基-1-丙烯是由2-甲基-1-丙烯发生加聚反应得到,所以可以通过加聚反应制得,故A正确;
B.聚2-甲基-1-丙烯是由2-甲基-1-丙烯发生加聚反应得到,所以聚2-甲基-1-丙烯的分子式为 (C4H8)n,故B正确;
C.该聚合物中只含C、H元素,所以其完全燃烧生成二氧化碳和水,故C正确;
D.聚异丁烯中不含碳碳双键,所以没有烯烃的性质,则不能和溴发生加成反应,故D错误;
故选D.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,明确官能团及其性质关系是解本题关键,侧重考查烯烃及高分子化合物性质,易错选项是D.

练习册系列答案
相关题目
20.下列说法正确的是( )
| A. | 铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连 | |
| B. | 向氨水中不断通入CO2,随着CO2的增加,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 | |
| C. | 3C(s)+CaO(s)=CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| D. | 合成氨时,其他条件不变升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |
18.下列“化学与生活”的说法不正确的是( )
| A. | 小苏打可以用于面粉发酵 | B. | SO2可用于漂白纸浆 | ||
| C. | BaCO3在医学上用作钡餐 | D. | 醋可用于除去暖水瓶中的水垢 |
5.下列判断正确的是( )
| A. | 元素周期表中查得的相对原子质量为同使素的相对原子质量 | |
| B. | 化学键的变化一定会引起化学反应的变化 | |
| C. | 酸性氧化物一定是非金属氧化物 | |
| D. | 钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水 |
15.三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物.探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,Cu2O在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是溶液变为血红色.
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?不合理.
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是Fe2O3和Cu2O的混合物,写出发生反应的离子方程式Fe2O3+6H+=2Fe3++3H2O;Cu2O+2H+=Cu+Cu2++H2O;2Fe3++Cu=2Fe2++Cu2+.
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为$\frac{9(b-a)}{a}×100%$.
(5)欲利用红色粉末Fe2O3和Cu2O的混合物制取较纯净的胆矾(CuSO4?5H2O),经查阅资料得知,在溶液中调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH
实验室有下列试剂可供选择:
A.氯水
B.H2O2
C.硝酸
D.NaOH
E.氨水
F.Cu2(OH)2CO3
实验小组设计如下实验方案:
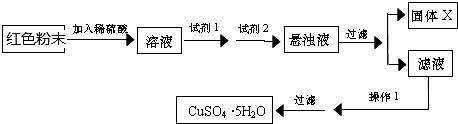
试回答:①试剂I为B,试剂II为F(填字母).
②固体X的化学式为Fe(OH)3.
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,Cu2O在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是溶液变为血红色.
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?不合理.
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是Fe2O3和Cu2O的混合物,写出发生反应的离子方程式Fe2O3+6H+=2Fe3++3H2O;Cu2O+2H+=Cu+Cu2++H2O;2Fe3++Cu=2Fe2++Cu2+.
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为$\frac{9(b-a)}{a}×100%$.
(5)欲利用红色粉末Fe2O3和Cu2O的混合物制取较纯净的胆矾(CuSO4?5H2O),经查阅资料得知,在溶液中调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH[来: | 13 | 14 | 3.7 |
A.氯水
B.H2O2
C.硝酸
D.NaOH
E.氨水
F.Cu2(OH)2CO3
实验小组设计如下实验方案:

试回答:①试剂I为B,试剂II为F(填字母).
②固体X的化学式为Fe(OH)3.
17.所有原子都在一条直线上的分子是( )
| A. | C2H4 | B. | CH≡CH | C. | CH3C≡CH | D. | CH4 |
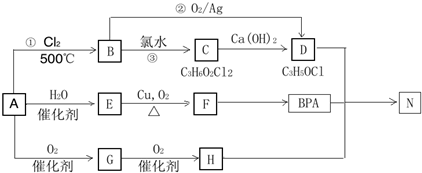

 .
.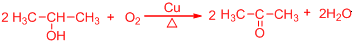 .
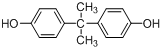
.
 .
.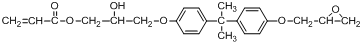
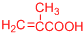 (或
(或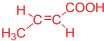 、
、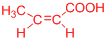 ).
).