题目内容
19.由二氧化碳、氢气、一氧化碳组成的混合气体在同温、同压下与氮气的密度相同.则该混合气体中二氧化碳、氢气、一氧化碳的体积比为( )| A. | 29:8:13 | B. | 22:1:14 | C. | 13:8:13 | D. | 26:16:13 |
分析 由于CO与N2具有相同的相对分子质量,所以CO2、H2、CO混合气体的平均相对分子质量仅由CO2和H2来决定,CO的量可以任意.用十字交叉法可以得出结果.
解答 解:由于CO与N2具有相同的相对分子质量,所以CO2、H2、CO混合气体的平均相对分子质量仅由CO2和H2来决定,CO的量可以任意.由十字交叉法:
由十字交叉法可求得CO2和H2的体积比为26:16或13:8时(CO的量可以任意),混合气体的平均分子量为28.
故选C、D.
点评 本题考查混合物的计算,关键是确定混合气体中CO2和H2的平均相对分子质量为28,侧重于学生的分析能力和计算能力的考查,注意十字交叉法的运用,难度中等.

练习册系列答案
相关题目
7.有机化合物与无机化合物在结构和性质上没有截然不同的区别.十九世纪中叶,科学家们用一系列实验证明了这一点.其中最著名的实验是1828年德国青年化学家维勒(Wohler)在蒸发氰酸铵溶液(NH4CNO)时得到了一种有机物,该有机物是( )
| A. | 乙酸(CH3COOH) | B. | 氨基乙酸(H2N-CH2-COOH) | ||
| C. | 尿素(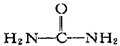 ) ) | D. | 硝化甘油(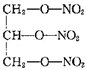 ) ) |
4.2SO2(g)+O2(g)═2SO3(g)的反应中,反应1分钟后,SO3的浓度增加了0.9mol/L,则O2表示的平均速率为( )
| A. | 0.45mol/(L•min) | B. | 0.55mol/(L•min) | C. | 0.60mol/(L•min) | D. | 0.90mol/(L•min) |
11.下列事实可用勒夏特列原理解释的是( )
| A. | 开启啤酒瓶后,瓶中立刻泛起大量泡沫 | |
| B. | 硫酸工业中,将黄铁矿粉碎后加入沸腾炉中 | |
| C. | 500℃左右比在室温时更有利于提高合成氨的转化率 | |
| D. | 对2HI?H2+I2平衡体系增加压强使颜色变深 |
8.下列离子方程式中,正确的是( )
| A. | 氨气通入醋酸中:CH3COOH+NH3═CH3COO-+NH4+ | |
| B. | 向碳酸氢镁溶液中加过量石灰水:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+MgCO3↓ | |
| C. | 澄清石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H2O | |
| D. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
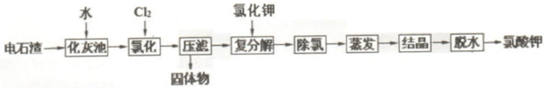
9.电石制取乙炔产生大量废渣:电石渣(主要成分为Ca(OH)2,另外还含有Fe和Al化学物及SO2等杂质),可用下面工艺实现电石渣吸收氯碱工业废气中的氯气,综合治理废渣和废气,回答下列问题:
已知:①几种物质溶解度与温度的关系
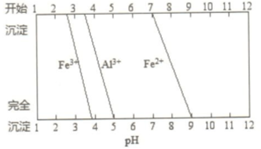
②几种离子开始和完全沉淀与pH的关系图
(1)某导电塑料是以乙炔为单体加聚合成,其化学为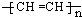 .
.
(2)化灰池中为加快水浸的速度,常采取的措施搅拌、加热.
(3)为除去Fe/Al 等杂质,氯化过程中需要控制溶液 pH为6-7.
(4)氯化过程的温度控制在 75~80℃,该过程主要反应的离子方程式为6Cl2+6Ca(OH)2=6Ca2++10Cl-+2ClO3-. 温度过低会发生副反应,产生的副产物为Ca(ClO)2(写化学式).
(5)复分解反应中,常控制温度为 20℃,加入KCl 发生的反应的方程式Ca(ClO3)2+2KCl=CaCl2+2KClO3+6H2O.
(6)通常用石墨电极电解 KClO 溶液制备 KClO3,则阳极的电极反应方程式为ClO--4e-+2H2O=ClO3-+4H+.
脱水过程实现固液分离,工业常用的设备是C
A.蒸馏塔 B.反应釜 C.离心机 D.交换器
(7)现代工艺氯化时通入O2做氧化剂提高效率,其氯化的化学方程式为2Ca(OH)2+2Cl2+5O2=2Ca(ClO3)2+2H2O.

已知:①几种物质溶解度与温度的关系
| 温度/ | 0 | 10 | 20 | 30 | 40 |
| S(CaCl2)/g | 59.5 | 64.7 | 74.5 | 100 | 128 |
| S[Ca(ClO3)2]/g | 209 | ||||
| S(KClO3)/g | 3.3 | 5.2 | 7.3 | 10.2 | 13.9 |

(1)某导电塑料是以乙炔为单体加聚合成,其化学为
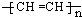 .
.(2)化灰池中为加快水浸的速度,常采取的措施搅拌、加热.
(3)为除去Fe/Al 等杂质,氯化过程中需要控制溶液 pH为6-7.
(4)氯化过程的温度控制在 75~80℃,该过程主要反应的离子方程式为6Cl2+6Ca(OH)2=6Ca2++10Cl-+2ClO3-. 温度过低会发生副反应,产生的副产物为Ca(ClO)2(写化学式).
(5)复分解反应中,常控制温度为 20℃,加入KCl 发生的反应的方程式Ca(ClO3)2+2KCl=CaCl2+2KClO3+6H2O.
(6)通常用石墨电极电解 KClO 溶液制备 KClO3,则阳极的电极反应方程式为ClO--4e-+2H2O=ClO3-+4H+.
脱水过程实现固液分离,工业常用的设备是C
A.蒸馏塔 B.反应釜 C.离心机 D.交换器
(7)现代工艺氯化时通入O2做氧化剂提高效率,其氯化的化学方程式为2Ca(OH)2+2Cl2+5O2=2Ca(ClO3)2+2H2O.
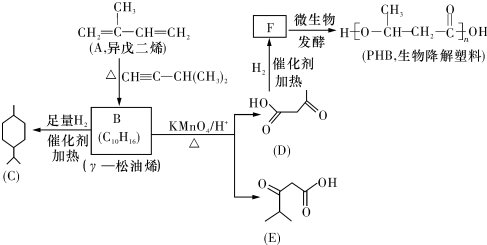
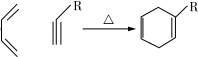
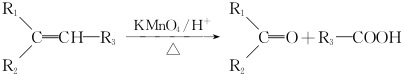
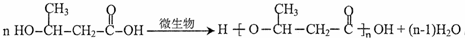 .
.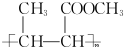 (一种类似有机玻璃的塑料).在催化剂作用下,第三步反应的化学方程式是
(一种类似有机玻璃的塑料).在催化剂作用下,第三步反应的化学方程式是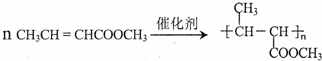 .
.