题目内容
10.某小组同学利用下图所示装置探究氨气的性质.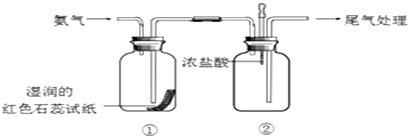
请回答:
(1)实验室用氯化铵和氢氧化钙共热制取氨气,该反应的化学方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O.
(2)①中湿润的红色石蕊试纸变蓝,说明氨气的水溶液显a(填字母)a.碱性 b.还原性
(3)向②中滴入浓盐酸,现象是有白烟生成.
(4)①、②中的现象说明氨气能与H2O、HCl(填化学式)发生化学反.
(5)尾气处理的方法可以是用倒扣的小漏斗通入水中.
分析 (1)实验室用加热氯化铵和氢氧化钙混合物的方法制取氨气;
(2)氨气易溶于水,氨水显碱性;
(3)氨气与氯化氢反应;
(4)根据氨气的性质分析;
(5)因为氨气极易溶于水,所以可以用水吸收过量氨气,但是吸收氨气时要用防倒吸装置.
解答 解:(1)在加热条件下,氯化铵和氢氧化钙反应生成氯化钙、氨气和水,反应方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O;
(2)氨气极易溶于水,氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子和铵根离子而使溶液呈碱性,无色酚酞试液遇碱变红色,
故答案为:a;
(3)向②中滴入浓盐酸,生成氯化铵固体,有白烟生成;
故答案为:有白烟生成;
(4)①、②中的现象说明氨气能与H2O、HCl反应,分别生成一水合氨、氯化铵,故答案为:H2O、HCl;
(5)因为氨气极易溶于水,所以可以用水吸收过量氨气,但是吸收氨气时要用防倒吸装置,所以尾气的处理方法是用倒扣的小漏斗通入水中,
故答案为:用倒扣的小漏斗通入水中.
点评 本题考查了氨气的制备及氨气的性质,题目难度中等,掌握物质性质和实验基本操作是解题关键,注意积累实验室中常用的防倒吸装置.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
20.氰化物有剧毒,我国工业废水中氰化物(CN-)的处理方法是:在碱性条件下,用Cl2将废水的中CN-转化成N2和CO2等,使废水得到净化.发生的反应为:2CN-+8OH-+5Cl2═2CO2↑+N2↑+10Cl-+4H2O.下列有关说法正确的是( )
| A. | 上述反应中氧化产物只有N2 | |
| B. | 经测定,NaCN的水溶液呈碱性,说明CN-能促进水的电离 | |
| C. | 若上述反应生成0.4molCO2,则溶液中阴离子增加的物质的量为2mol | |
| D. | 现取1L含CN-1.04mg/L的废水,理论需用4.010-5molCl2处理 |
1.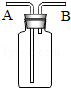 下面关于图所示实验装置的使用方法中叙述正确的是( )
下面关于图所示实验装置的使用方法中叙述正确的是( )
①用于排水集气:充满水,B进气,A排放水
②用于收集密度比空气大的气体:A进气,B排放空气
③用于收集密度比空气小的气体:B进气,A排放空气
④用于洗气:装入洗液,A进气,B出气
⑤用于测量气体的体积:充满水,B进气,A出水,计算溢出水的体积.
 下面关于图所示实验装置的使用方法中叙述正确的是( )
下面关于图所示实验装置的使用方法中叙述正确的是( )①用于排水集气:充满水,B进气,A排放水
②用于收集密度比空气大的气体:A进气,B排放空气
③用于收集密度比空气小的气体:B进气,A排放空气
④用于洗气:装入洗液,A进气,B出气
⑤用于测量气体的体积:充满水,B进气,A出水,计算溢出水的体积.
| A. | 全正确 | B. | ②③④⑤ | C. | ①③④⑤ | D. | ①②③④ |
5.在氨水的下列性质中,可以证明它是弱电解质的是( )
①1摩/升氨水溶液的pH值约为11.6
②浓氨水可与水以任何比例互溶
③20毫升1摩/升氨水恰好与20毫升1摩/升HCl溶液完全反应
④在相同条件下,氨水的导电性比盐酸弱.
①1摩/升氨水溶液的pH值约为11.6
②浓氨水可与水以任何比例互溶
③20毫升1摩/升氨水恰好与20毫升1摩/升HCl溶液完全反应
④在相同条件下,氨水的导电性比盐酸弱.
| A. | ①、② | B. | ①、④ | C. | ①、③ | D. | ②、④ |
2.下列化学变化中属于取代反应的有( )
①光照甲烷与氯气的混合气体
②由乙烯制乙醇
③乙烯使溴水褪色
④乙烯使酸性高锰酸钾褪色
⑤乙醇与乙酸的酯化反应
⑥苯与液溴在三溴化铁催化下反应
⑦苯的硝化反应
⑧由乙烯制备聚乙烯.
①光照甲烷与氯气的混合气体
②由乙烯制乙醇
③乙烯使溴水褪色
④乙烯使酸性高锰酸钾褪色
⑤乙醇与乙酸的酯化反应
⑥苯与液溴在三溴化铁催化下反应
⑦苯的硝化反应
⑧由乙烯制备聚乙烯.
| A. | ①⑤⑥⑦ | B. | ①③④⑦⑧ | C. | ②③④⑤⑥⑦ | D. | ①②③④⑤⑥⑦ |
19.由二氧化碳、氢气、一氧化碳组成的混合气体在同温、同压下与氮气的密度相同.则该混合气体中二氧化碳、氢气、一氧化碳的体积比为( )
| A. | 29:8:13 | B. | 22:1:14 | C. | 13:8:13 | D. | 26:16:13 |
 物质结构决定物质性质.回答下列问题:
物质结构决定物质性质.回答下列问题: