题目内容
8.下列离子方程式中,正确的是( )| A. | 氨气通入醋酸中:CH3COOH+NH3═CH3COO-+NH4+ | |
| B. | 向碳酸氢镁溶液中加过量石灰水:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+MgCO3↓ | |
| C. | 澄清石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H2O | |
| D. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
分析 A.二者反应生成醋酸铵;
B.向碳酸氢镁溶液中加过量石灰水反应生成碳酸钙和氢氧化镁;
C.澄清石灰水应拆成离子形式;
D.二者不反应.
解答 解:A.氨气通入醋酸中:CH3COOH+NH3═CH3COO-+NH4+,故A正确;
B.碳酸氢镁溶液中加过量澄清石灰水,反应的离子方程式为:Mg2++2HCO3-+2Ca2++4OH-=2CaCO3↓+2H2O+Mg(OH)2↓,故B错误;
C.澄清石灰水与稀盐酸反应,离子方程式:OH-+H+═H2O,故C错误;
D.稀硫酸滴在铜片上不发生反应吗,故D错误;
故选:A.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,题目难度不大.

练习册系列答案
 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
19.由二氧化碳、氢气、一氧化碳组成的混合气体在同温、同压下与氮气的密度相同.则该混合气体中二氧化碳、氢气、一氧化碳的体积比为( )
| A. | 29:8:13 | B. | 22:1:14 | C. | 13:8:13 | D. | 26:16:13 |
16.氯化溴(BrCl)和Br2、Cl2具有相似的性质,下列有关氯化溴性质的判断中不正确的是( )
| A. | 在CCl4中的溶解性Cl2<BrCl<Br2 | |
| B. | BrCl氧化性比Br2强 | |
| C. | BrCl能使润湿的淀粉碘化钾试纸变蓝 | |
| D. | 常温下BrCl可与NaOH溶液反应生成NaClO和NaBr |
17. 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
(1)溴的价电子排布式为4s24p5;PCl3的空间构型为三角锥形.
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生.
A. CsICl2=CsCl+ICl B. CsICl2=CsI+Cl2
(3)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘.
(4)下列分子既不存在s-pσ键,也不存在p-pπ键的是D.
A. HCl B.HF C. SO2 D. SCl2
(5)已知COCl2为平面形,则COCl2中心碳原子的杂化轨道类型为sp2杂化,写出CO的等电子体的微粒N2(写出1个).
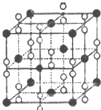
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:由此可判断该钙的氧化物的化学式为CaO2.已知该氧化物的密度是ρg•cm-3,则晶胞离得最近的两个钙离子间的距离为$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{4×72}{{ρ•N}_{A}}}$cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA).
 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.(1)溴的价电子排布式为4s24p5;PCl3的空间构型为三角锥形.
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生.
A. CsICl2=CsCl+ICl B. CsICl2=CsI+Cl2
(3)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘.
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |
A. HCl B.HF C. SO2 D. SCl2
(5)已知COCl2为平面形,则COCl2中心碳原子的杂化轨道类型为sp2杂化,写出CO的等电子体的微粒N2(写出1个).
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:由此可判断该钙的氧化物的化学式为CaO2.已知该氧化物的密度是ρg•cm-3,则晶胞离得最近的两个钙离子间的距离为$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{4×72}{{ρ•N}_{A}}}$cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA).
9.下列有关化学用语表示正确的是( )
| A. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C | |
| B. | Mg2+的结构示意图: | |
| C. | CO2的电子式: | |
| D. | 熔融状态下硫酸氢钾的电离方程式:KHSO4$\frac{\underline{\;熔融\;}}{\;}$K++H++SO42- |
 物质结构决定物质性质.回答下列问题:
物质结构决定物质性质.回答下列问题: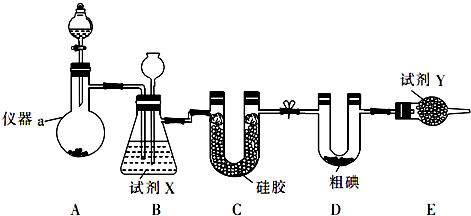
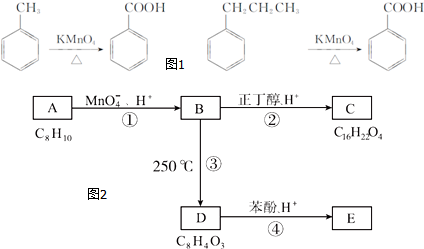
 .
.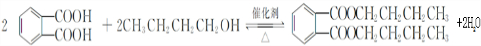 ,该反应的类型为取代反应.
,该反应的类型为取代反应.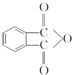 ,在D物质的核磁共振氢谱图中,会出现2组峰,峰面积之比为1:1.
,在D物质的核磁共振氢谱图中,会出现2组峰,峰面积之比为1:1.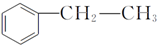 (写结构简式).
(写结构简式).