题目内容
14.化学作为一门基础自然科学,在材料科学、生命科学、能源科学等诸多领域发挥着重要作用.(1)高温超导材料钇钡铜氧的化学式为YBaCu3O7,其中$\frac{1}{3}$的Cu以罕见的Cu3+形式存在.Cu在元素周期表中的位置为第四周期第ⅠB族,基态Cu3+的核外电子排布式为1s22s22p63s23p63d8.
(2)磁性材料在生活和科学技术中应用广泛.研究表明,若构成化合物的阳离子有未成对电子时,则该化合物具有磁性.下列物质适合作录音磁带磁粉原料的为B(填选项字母).
A.V2O5 B.CrO2 C.PbO D.ZnO
(3)屠呦呦因在抗疟药--青蒿素研究中的杰出贡献,成为首获科学类诺贝尔奖的中国人.青蒿素的结构简式如图l所示,其组成元素的电负性由大到小的顺序为O>C>H;碳原子的杂化方式为sp2、sp3.
(4)“可燃冰”因储量大、污染小被视为未来石油的替代能源,由甲烷和水形成的“可燃冰”结构如图2所示.
①“可燃冰”中分子间存在的2种作用力为氢键、范德华力.
②H20的VSEPR模型为四面体形.比较键角的大小:H2O<CH4(填“>”“<”或“=”),原因为甲烷分子的杂化轨道中无孤电子对,而H2O分子有两对孤对电子,孤对电子与成键电子的排斥力大、键角小
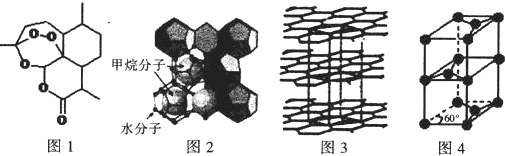
(5)锂离子电池在便携式电子设备以及电动汽车、卫星等领域显示出广阔的应用前景.该电池负极材料为石墨,石墨为层状结构(如图3),其晶胞结构如图4所示,该晶胞中有4个碳原子.已知石墨的层间距为apm,C-C键长为b pm,阿伏伽德罗常数的值为NA,则石墨晶体的密度为$\frac{16×1{0}^{30}}{\sqrt{3}a{b}^{3}{N}_{A}}$g.cm-3(列出计算式).
分析 (1)Cu原子核外电子数为29,原子核外电子排布式为1s22s22p63s23p63d104s1,失去4s能级1个电子、3d能级2个电子形成Cu3+;
(2)构成化合物的阳离子有未成对电子时,该化合物具有磁性,适合作录音磁带磁粉原料,根据离子核外电子排布式判断;
(3)青蒿素的组成元素有C、H、H,非金属性越强电负性越大;分子中酯基中C原子为形成3个σ键、其它碳原子形成4个σ键,均没有孤对电子;
(4)①水分子之间形成氢键,分子之间还存在范德华力;
②H2O分子中O原子形成2个σ键、含有2对孤电子对;孤对电子与成键电子的排斥力比成键电子之间排斥力大;
(5)根据均摊法计算晶胞中C原子数目,C-C键长为b pm,则上、下底面为菱形,上底面棱长为b pm×$\frac{\sqrt{3}}{2}$×2=$\sqrt{3}$b pm,石墨的层间距为apm,则晶胞高为2a pm,计算晶胞质量,根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)Cu原子核外电子数为29,原子核外电子排布式为1s22s22p63s23p63d104s1,处于周期表中第四周期第ⅠB族,失去4s能级1个电子、3d能级2个电子形成Cu3+,基态Cu3+的核外电子排布式为1s22s22p63s23p63d8,
故答案为:第四周期第ⅠB族;1s22s22p63s23p63d8;
(2)A.V2O5 中V5+的核外电子排布式为1s22s22p63s23p6,没有未成对电子,没有磁性;
B.CrO2 中Cr4+的核外电子排布式为1s22s22p63s23p63d2,有未成对电子,具有磁性;
C.PbO 中Pb处于IVA族,失去p能级2电子形成Pb2+,没有未成对电子,没有磁性;
D.ZnO中Zn2+的核外电子排布式为1s22s22p63s23p63d10,没有未成对电子,没有磁性,
CrO2适合作录音磁带磁粉原料,
故选:B;
(3)青蒿素的组成元素有C、H、H,非金属性越强电负性越大,故电负性O>C>H;分子中酯基中C原子为形成3个σ键、其它碳原子形成4个σ键,均没有孤对电子,碳原子的杂化方式为 sp2、sp3,
故答案为:O>C>H;sp2、sp3;
(4)①水分子之间形成氢键,分子之间还存在范德华力,故答案为:氢键、范德华力;
②H2O分子中O原子形成2个σ键、含有2对孤电子对,VSEPR模型为四面体形;甲烷分子的杂化轨道中无孤电子对,而H2O分子有两对孤对电子,孤对电子与成键电子的排斥力大、键角小,则键角H2O<CH4,
故答案为:四面体形;<;甲烷分子的杂化轨道中无孤电子对,而H2O分子有两对孤对电子,孤对电子与成键电子的排斥力大、键角小;
(5)根据均摊法,晶胞中C原子数目=1+8×$\frac{1}{8}$+4×$\frac{1}{4}$+2×$\frac{1}{2}$=4,晶胞质量为$\frac{4×12}{{N}_{A}}$g,C-C键长为b pm,则上、下底面为菱形,上底面棱长为b pm×$\frac{\sqrt{3}}{2}$×2=$\sqrt{3}$b pm,石墨的层间距为apm,则晶胞高为2a pm,则晶胞密度为$\frac{4×12}{{N}_{A}}$g÷{[2×$\frac{1}{2}$×$\sqrt{3}$b×10-10×$\sqrt{3}$b×10-10×sin60°cm]×2a×10-10cm}=$\frac{16×1{0}^{30}}{\sqrt{3}a{b}^{3}{N}_{A}}$g.cm-3,
故答案为:$\frac{16×1{0}^{30}}{\sqrt{3}a{b}^{3}{N}_{A}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电负性、杂化方式、价层电子对互斥理论、晶胞计算等,(5)为易错点、难点,需要学生具备一定的空间想象与数学计算能力,难度较大.

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案①1摩/升氨水溶液的pH值约为11.6
②浓氨水可与水以任何比例互溶
③20毫升1摩/升氨水恰好与20毫升1摩/升HCl溶液完全反应
④在相同条件下,氨水的导电性比盐酸弱.
| A. | ①、② | B. | ①、④ | C. | ①、③ | D. | ②、④ |
①光照甲烷与氯气的混合气体
②由乙烯制乙醇
③乙烯使溴水褪色
④乙烯使酸性高锰酸钾褪色
⑤乙醇与乙酸的酯化反应
⑥苯与液溴在三溴化铁催化下反应
⑦苯的硝化反应
⑧由乙烯制备聚乙烯.
| A. | ①⑤⑥⑦ | B. | ①③④⑦⑧ | C. | ②③④⑤⑥⑦ | D. | ①②③④⑤⑥⑦ |
| A. | 1mol NH4+ 含有的电子总数为10NA | |
| B. | 1mol Mg 与足量盐酸反应时失去NA个电子 | |
| C. | 28g N2 所含原子数目为NA | |
| D. | 在101KPa、25℃条件下,11.2L H2 中含有的原子数目为NA |
| A. | 29:8:13 | B. | 22:1:14 | C. | 13:8:13 | D. | 26:16:13 |
| A. | 容器内压强不随时间变化 | |
| B. | 容器内各物质的浓度相等 | |
| C. | 容器内 X、Y、Z 的浓度之比为 1:2:2 | |
| D. | 单位时间消耗 0.1molX 同时生成 0.2molZ |
| A. | 遇酚酞变红的溶液中:Na+、Cl-、Ba2+、CH3COO- | |
| B. | 常温下Kw/c(H+)=1×10-13mol/L的溶液中:SO42-、Fe2+、ClO-、NH4+ | |
| C. | 水电离出的c(H+)=10-10mol/L的溶液中:Na+、K+、Cl-、HCO3- | |
| D. | 0.5mol/LAlCl3溶液中可能大量存在:Ca2+、AlO2-、K+、CO32- |
 CH4、NH3、H2O和HF均为含10e-的分子.
CH4、NH3、H2O和HF均为含10e-的分子.