题目内容
20.取两份质量相等的有机物M,一份与Na2CO3溶液反应最多放出气体V1升,另一份与足量的钠反应放出气体V2升,;若同温同压下V2>V1>0,则M可能是( )| A. | 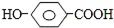 | B. | HO(CH2)2CHO | C. | HOOC-COOH | D. | CH3COOH |
分析 能与钠反应的有机物可能含有-OH、-COOH,能与Na2CO3溶液反应放出气体,有机物含有-COOH.
质量相等的有机物M,物质的量相等,令物质的量为1mol,计算生成气体物质的量,相同条件下物质的量之比等于体积之比,结合生成气体体积判断.
解答 解:设有机物均为1mol,则2-OH~H2↑、2-COOH~CO2↑,
A.含-OH与-COOH,1mol该物质与Na2CO3溶液反应生成0.5mol气体,与Na反应生成1mol气体,则V2>V1>0,故A选;
B.含-OH、-CHO,不能与碳酸钠溶液反应,故B不选;
C.含2个-COOH,1mol该物质与Na2CO3溶液反应生成1mol气体,与Na反应生成1mol气体,则V2=V1>0,故C不选;
D.含1个-COOH,1mol该物质与Na2CO3溶液反应生成0.5mol气体,与Na反应生成0.5mol气体,则V2=V1>0,故D不选;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物官能团与性质的关系为解答关键,注意醇与羧酸的性质,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
10.下列事实与氢键有关的是( )
| A. | 水加热到很高的温度都难以分解 | |
| B. | 水结成冰体积膨胀,密度变小 | |
| C. | 水分解成氢气和氧气吸收热量 | |
| D. | HF、HCl、HBr、HI的热稳定性依次减弱 |
11.对于原电池的电极名称,下列叙述有错误的是( )
| A. | 负极发生氧化反应 | B. | 正极为电子流入的一极 | ||
| C. | 比较不活泼的金属为负极 | D. | 负极为失去电子的一极 |
8.XY2是离子化合物,X和Y离子的电子层结构都与氖原子相同,则X、Y为( )
| A. | Ca和Cl | B. | K和S | C. | Ca和F | D. | Mg和F |
15.化学与生产、生活、科技等密切相关,下列说法正确的是( )
| A. | 苯酚稀溶液常用于外科消毒,所以自来水也可以用苯酚进行消毒处理 | |
| B. | 煤经气化和液化两个化学变化过程,可变为清洁能源 | |
| C. | 石油裂解的目的是提高汽油等轻质油的产量和质量 | |
| D. | “神州七号”的防护层中含聚四氟乙烯,聚四氟乙烯属于不饱和烃 |
5.A、B、C、D、E、F六种化合物,其中A、B、C、D、E均由短周期元素组成,焰色反应均为黄色,B、C、E均由三种元素组成.B、C的组成元素相同,且C的摩尔质量比B大80g/mol,回答:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为AC
A、离子键 B、极性共价键 C、非极性共价键 D、氢键
下表为B与F实验的部分内容
写出B与稀H2SO4反应的离子方程式S2O32-+2H+=S↓+SO2↑+H2O
写出②中反应的化学方程式FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl
(3)现由6种粒子Mn2+、MnO${\;}_{4}^{-}$、H+、H2O、X2Y${\;}_{8}^{2-}$(C中含有的阴离子),XY${\;}_{4}^{2-}$完成一个离子方程式,已知Mn2+为还原剂,得到1molMnO${\;}_{4}^{-}$需氧化剂的物质的量为2.5mol
(4)化合物D和E相互转化D$?_{CO_{2}•H_{2}O}^{△}$ E,若有D和E•xH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为8.4g,E•xH2O的化学式为Na2C03•7H2O.
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为AC
A、离子键 B、极性共价键 C、非极性共价键 D、氢键
下表为B与F实验的部分内容
| ①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
| ②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
| ③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
写出②中反应的化学方程式FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl
(3)现由6种粒子Mn2+、MnO${\;}_{4}^{-}$、H+、H2O、X2Y${\;}_{8}^{2-}$(C中含有的阴离子),XY${\;}_{4}^{2-}$完成一个离子方程式,已知Mn2+为还原剂,得到1molMnO${\;}_{4}^{-}$需氧化剂的物质的量为2.5mol
(4)化合物D和E相互转化D$?_{CO_{2}•H_{2}O}^{△}$ E,若有D和E•xH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为8.4g,E•xH2O的化学式为Na2C03•7H2O.
12.氢化铵(NH4H)与氯化铵的结构相似,电子式为 ,又知NH4H与水反应有H2生成,下列叙述中不正确的是( )
,又知NH4H与水反应有H2生成,下列叙述中不正确的是( )
①NH4H是离子化合物,含有离子键和共价键
②NH4H溶于水所形成的溶液显酸性
③NH4H与水反应时,NH4H是氧化剂
④NH4H固体投入少量的水中,有两种气体生成.
 ,又知NH4H与水反应有H2生成,下列叙述中不正确的是( )
,又知NH4H与水反应有H2生成,下列叙述中不正确的是( )①NH4H是离子化合物,含有离子键和共价键
②NH4H溶于水所形成的溶液显酸性
③NH4H与水反应时,NH4H是氧化剂
④NH4H固体投入少量的水中,有两种气体生成.
| A. | ①② | B. | ②③ | C. | ①②③ | D. | 全部 |
9.在AlCl3和FeCl3的混合液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得到的沉淀物是( )
| A. | Fe2S3、I2 | B. | FeS、S、Al(OH)3 | C. | Al(OH)3、I2 | D. | Fe(OH)3、Al(OH)3 |