题目内容
8.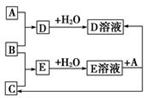 已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按如图框图进行反应.
已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按如图框图进行反应.回答下列问题:
(1)组成单质A、B、C的三种元素中的任意两种元素形成的化合物所属物质类别一定不是③⑤.
①氢化物 ②酸 ③碱 ④盐 ⑤氧化物
(2)如果E溶液是一种强酸,则E的化学式为HCl.
分析 (1)两种元素不能形成碱,D和E溶于水得到相应的溶液,所以形成的化合物不能是氧化物;
(2)如果E溶液是一种强酸,且只含有2种元素,则E为HCl.
解答 解:(1)A、B、C的三种元素中的任意两种元素不能形成碱,D和E溶于水得到相应的溶液,所以形成的化合物不能是氧化物,故选:③⑤;
(2)如果E溶液是一种强酸,且只含有2种元素,则E为HCl,A可以为Al、B为氯气、C为氢气、D为氯化铝,故答案为:HCl.
点评 本题考查无机物推断、物质分类与组成等,理解掌握酸、碱、盐与氧化物等基本概念,熟练掌握元素化合物性质,注意对基础知识的理解掌握,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.对下列物质的分类正确的是( )
| A. | 稀盐酸属于纯净物 | B. | SO2属于酸性氧化物 | ||
| C. | 纯碱属于碱 | D. | Mn2O7属于碱性氧化物 |
19.下列化合物不能由单质直接化合得到的是( )
| A. | CuCl2 | B. | FeCl2 | C. | HCl | D. | Na2O2 |
16.据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电.其电池反应为:
2CH3OH+3O2+4OH-$?_{充电}^{放电}$ 2CO32-+6H2O则下列说法错误的( )
2CH3OH+3O2+4OH-$?_{充电}^{放电}$ 2CO32-+6H2O则下列说法错误的( )
| A. | 放电时CH3OH参与反应的电极为正极 | |
| B. | 充电时电解质溶液的pH逐渐增大 | |
| C. | 放电时负极的电极反应为:2CH3OH-12e-+16OH-═2CO32-+12H2O | |
| D. | 充电时每生成1 mol CH3OH转移6 mol电子 |
13.由MgO、A12O3、SiO2、Fe2O3组成的混合粉末.现取一份该混合粉末试样进行实验,首先将其溶于过量的盐酸,过滤后,得到沉淀X和滤液Y.下列叙述正确的是( )
| A. | 从组成看,其成分皆是碱性氧化物 | |
| B. | 沉淀X的成分是SiO2 | |
| C. | 溶液Y中的阳离子主要是Mg2+、Fe3+、H+ | |
| D. | 在溶液Y中加入过量NaOH溶液,先产生沉淀后全部溶解 |
20.下列说法正确的是( )
| A. | 用镀锡铁做罐头盒,当镀层破坏后锡能对铁提供保护 | |
| B. | 用铜作电极电解稀硫酸,发生反应:Cu+H2SO4$\frac{\underline{\;通电\;}}{\;}$CuSO4+H2↑ | |
| C. | 某原电池的电极材料分别为Mg和Al,则Mg一定做负极 | |
| D. | 某可逆反应升高温度,活化能大的方向化学反应速率增大程度小 |
17.将下列液体分别与溴水混合并振荡,静置后分为两层,溴水层几乎呈无色的是( )
| A. | 氯水 | B. | 乙烯 | C. | 乙醇 | D. | 碘化钾溶液 |
18.为了除去镀在铁制品表面的铜镀层,可选用的试剂是( )
| A. | 稀硝酸 | B. | 浓硝酸 | C. | 浓硫酸 | D. | 浓盐酸 |