题目内容
16.据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电.其电池反应为:2CH3OH+3O2+4OH-$?_{充电}^{放电}$ 2CO32-+6H2O则下列说法错误的( )
| A. | 放电时CH3OH参与反应的电极为正极 | |
| B. | 充电时电解质溶液的pH逐渐增大 | |
| C. | 放电时负极的电极反应为:2CH3OH-12e-+16OH-═2CO32-+12H2O | |
| D. | 充电时每生成1 mol CH3OH转移6 mol电子 |
分析 放电时,相当于原电池的工作原理,正极上氧气发生得电子的还原反应,负极甲醇发生失电子的氧化反应;充电时,相当于电解池的工作原理,根据反应方程式来确定溶液的酸碱性并判断电子转移的量.
解答 解:A、放电时,相当于原电池的工作原理,负极发生失电子的氧化反应,根据总反应可知,放电时CH3OH失电子,在负极上反应,故A错误;
B、充电时,相当于电解池的工作原理,根据总反应:2CH3OH+3O2+4OH-$?_{充电}^{放电}$ 2CO32-+6H2O,生成大量的氢氧根离子,所以碱性增强,故电解质溶液的pH逐渐增大,故B正确;
C、放电时负极发生失电子的氧化反应,根据总反应:2CH3OH+3O2+4OH-$?_{充电}^{放电}$ 2CO32-+6H2O,则负极的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O,故C正确;
D、充电时,根据总反应:2CH3OH+3O2+4OH-$?_{充电}^{放电}$ 2CO32-+6H2O,每生成2molCH3OH转移12mol电子,则每生成1molCH3OH转移6mol电子,故D正确.
故选A.
点评 本题考查了化学电源新型电池,明确元素的化合价变化、氧化还原反应与原电池反应的关系是解答本题的关系,知道阴、阳极正好是原电池的负极、正极上反应的逆反应,为易错点.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
6.在化学式为C6H14的烷烃分子中,含有三个甲基的同分异构体的数目是( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
7.Na3N、氢铝化合物(AlH3)n(最简单的氢铝化合物是Al2H6)等是具有化学特性的物质,下列叙述正确的是( )
| A. | 离子半径:Na+>N3->H+ | |
| B. | 氢铝化合物与水反应生成氢氧化铝和氢气 | |
| C. | 与盐酸反应都只生成一种盐 | |
| D. | 与水反应都是氧化还原反应 |
4.在稀硫酸中加入铜粉,铜粉不溶解,再加入下列固体粉末:①FeCl2②Fe2O3③Zn④KNO3,铜粉可以溶解的是( )
| A. | ①② | B. | ①④ | C. | ②④ | D. | ②③④ |
11.下列物质中,既能与盐酸反应又能与NaOH溶液反应的是( )
①NaHCO3②Al ③Al2O3 ④Al(OH)3 ⑤NaAlO2 ⑥(NH4)2CO3.
①NaHCO3②Al ③Al2O3 ④Al(OH)3 ⑤NaAlO2 ⑥(NH4)2CO3.
| A. | ②③④⑤ | B. | ①③④⑥ | C. | ①②③④⑥ | D. | 全部 |
1.下列离子方程式的书写正确的是( )
| A. | 误将洁厕灵与消毒液混合:2H++Cl-+ClO-═Cl2↑+H2O | |
| B. | 向100mL0.1mol/L FeBr2溶液中通入0.0125mol Cl2:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| C. | 高锰酸钾酸性溶液吸收二氧化硫:SO2+MnO4-+4H+═SO42-+Mn2++2H2O | |
| D. | 向明矾溶液中加入过量的氢氧化钡溶液:Al3++SO42-+Ba2++4OH-═BaSO4↓+[Al(OH)4]- |
5.相同质量的铜片分别投入到足量的下列四种酸中(必要时可加热),充分反应后在相同条件下得到的气体体积由大到小的顺序是( )
①浓硫酸 ②浓硝酸 ③稀硫酸 ④稀硝酸.
①浓硫酸 ②浓硝酸 ③稀硫酸 ④稀硝酸.
| A. | ②④①③ | B. | ③④①② | C. | ①②④③ | D. | ②①④③ |
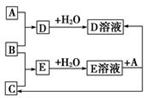 已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按如图框图进行反应.
已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按如图框图进行反应.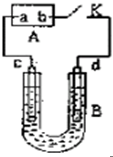 如图,A为直流电源,B为电解槽,c、d为石墨电极,B中存放有100mL NaCl和CuCl2的混合溶液,其中Cu2+的物质的量浓度为0.1mol/L,闭合K,d极收集到标准状况下448mL的一种气体甲,该气体能使湿润的碘化钾淀粉试纸变蓝.气体体积均在标准状况下测定,假设溶液的体积变化忽略不计,不考虑电解产生的气体溶解和吸收.请回答下列问题.
如图,A为直流电源,B为电解槽,c、d为石墨电极,B中存放有100mL NaCl和CuCl2的混合溶液,其中Cu2+的物质的量浓度为0.1mol/L,闭合K,d极收集到标准状况下448mL的一种气体甲,该气体能使湿润的碘化钾淀粉试纸变蓝.气体体积均在标准状况下测定,假设溶液的体积变化忽略不计,不考虑电解产生的气体溶解和吸收.请回答下列问题.