题目内容
20.下列说法正确的是( )| A. | 用镀锡铁做罐头盒,当镀层破坏后锡能对铁提供保护 | |
| B. | 用铜作电极电解稀硫酸,发生反应:Cu+H2SO4$\frac{\underline{\;通电\;}}{\;}$CuSO4+H2↑ | |
| C. | 某原电池的电极材料分别为Mg和Al,则Mg一定做负极 | |
| D. | 某可逆反应升高温度,活化能大的方向化学反应速率增大程度小 |
分析 A、锡的金属性小于铁、锌的金属性大于铁,所以镀层破损后?形成原电池,镀锡铁更容易被腐蚀;
B、金属铜是活泼电极,电解硫酸溶液在阴极上是硫酸中的氢离子发生得电子的还原反应;
C、在原电池中,发生失电子氧化反应的电极是负极;
D、正逆反应的活化能大小是相同的.
解答 解:A、镀锡铁桶和镀锌铁桶在镀层破损后,铁和锡、铁和锌构成了原电池,其中镀锡的铁桶中,铁为原电池的负极,更容易被腐蚀,故A错误;
B、用铜作电极电解稀硫酸,金属铜是活泼电极,电解硫酸溶液在阴极上是硫酸中的氢离子发生得电子的还原反应,发生总反应为Cu+H2SO4$\frac{\underline{\;通电\;}}{\;}$CuSO4+H2↑,故B正确;
C、原电池的电极材料分别为Mg和Al,若是氢氧化钠作电解质,此则Mg不做负极,做正极,故C错误;
D、可逆反应升高温度,吸热方向化学反应速率增大程度大,故D错误.
故选B.
点评 本题涉及金属的腐蚀和防护、电解池的工作原理以及原电池的构成、温度对反应速率的影响等方面知识,属于综合知识的考查,难度不大.

练习册系列答案
相关题目
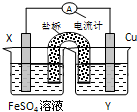
10.下列图示实验正确的是( )
| A. |  除去粗盐溶液中的不溶物 | B. | 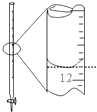 记录滴定终点读数为12.20ml | ||
| C. | 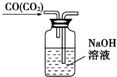 除去CO气体中的CO2气体 | D. | 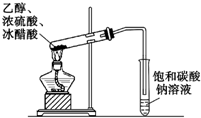 乙酸乙酯制备演示实验 |
11.下列物质中,既能与盐酸反应又能与NaOH溶液反应的是( )
①NaHCO3②Al ③Al2O3 ④Al(OH)3 ⑤NaAlO2 ⑥(NH4)2CO3.
①NaHCO3②Al ③Al2O3 ④Al(OH)3 ⑤NaAlO2 ⑥(NH4)2CO3.
| A. | ②③④⑤ | B. | ①③④⑥ | C. | ①②③④⑥ | D. | 全部 |
15.下列说法正确的是( )
| A. | 原电池是将电能转变为化学能的装置 | |
| B. | 原电池阳极发生氧化反应 | |
| C. | 电解池阴极发生还原反应 | |
| D. | 电解池的阴极连接电源正极 |
5.相同质量的铜片分别投入到足量的下列四种酸中(必要时可加热),充分反应后在相同条件下得到的气体体积由大到小的顺序是( )
①浓硫酸 ②浓硝酸 ③稀硫酸 ④稀硝酸.
①浓硫酸 ②浓硝酸 ③稀硫酸 ④稀硝酸.
| A. | ②④①③ | B. | ③④①② | C. | ①②④③ | D. | ②①④③ |
9.钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用.完成下列计算:
(1)叠氮化钠(NaN3)受撞击完成分解产生钠和氮气,故可应用于汽车安全气囊.若产生40,.32L(标准状况下)氮气,至少需要叠氮化钠78g.
(2)钠-钾合金可在核反应堆中用作热交换液.5.05g钠-钾合金溶于200mL水生成0.075mol氢气.
①计算溶液中氢氧根离子的物质的量浓度0.75mol/L(忽略溶液体积变化).
②计算并确定该钠-钾合金的化学式NaK2
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液.向该溶液中通入二氧化碳,有下列反应:2NaAl(OH)4+CO2→2Al(OH)3↓+Na2CO3+H2O
已知通入二氧化碳336L(标准状况下),生成24mol Al(OH)3和15mol Na2CO3,若通入溶液的二氧化碳为112L(标准状况下),计算生成的 Al(OH)3和Na2CO3的物质的量之比为4:5
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠.通过计算,分析和比较上表3组数据,给出结论实验①所取氢氧化钠样品是NaOH、实验②和实验③所取氢氧化钠样品应该是NaOH•H2O.
(1)叠氮化钠(NaN3)受撞击完成分解产生钠和氮气,故可应用于汽车安全气囊.若产生40,.32L(标准状况下)氮气,至少需要叠氮化钠78g.
(2)钠-钾合金可在核反应堆中用作热交换液.5.05g钠-钾合金溶于200mL水生成0.075mol氢气.
①计算溶液中氢氧根离子的物质的量浓度0.75mol/L(忽略溶液体积变化).
②计算并确定该钠-钾合金的化学式NaK2
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液.向该溶液中通入二氧化碳,有下列反应:2NaAl(OH)4+CO2→2Al(OH)3↓+Na2CO3+H2O
已知通入二氧化碳336L(标准状况下),生成24mol Al(OH)3和15mol Na2CO3,若通入溶液的二氧化碳为112L(标准状况下),计算生成的 Al(OH)3和Na2CO3的物质的量之比为4:5
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
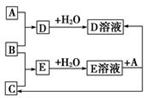 已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按如图框图进行反应.
已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按如图框图进行反应.