题目内容
按要求完成以下各题:
(1)2克乙炔完全燃烧生成液态水和CO2,放出99.6KJ热量.则乙炔的燃烧热△H= ,2摩尔乙炔完全燃烧放出的热量是 .
(2)写出乙二酸与乙二醇反应生成六元环状酯的方程式 (不必写反应条件)
(3)已知Na2S2O3+H2SO4═Na2SO4+S↓+SO2+H2O.甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如下(所取溶液体积均为10mL):
其他条件不变时:探究浓度对化学反应速率的影响,应选择 (填实验编号);探究温度对化学反应速率的影响,应选择 (填实验编号).写出该反应的离子方程式: .
(1)2克乙炔完全燃烧生成液态水和CO2,放出99.6KJ热量.则乙炔的燃烧热△H=
(2)写出乙二酸与乙二醇反应生成六元环状酯的方程式
(3)已知Na2S2O3+H2SO4═Na2SO4+S↓+SO2+H2O.甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如下(所取溶液体积均为10mL):
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol?L-1 | c(H2SO4)/mol?L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
考点:燃烧热,有关反应热的计算,化学反应速率的影响因素
专题:化学反应中的能量变化,化学反应速率专题
分析:(1)燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物;
(2)乙二酸与乙二醇发生酯化反应生成六元环状酯;
(3)要探究浓度对化学反应速率的影响,应选择温度相同条件下的实验;探究温度对化学反应速率的影响,应选择浓度相同条件下的实验;依据化学方程式写出离子方程式.
(2)乙二酸与乙二醇发生酯化反应生成六元环状酯;
(3)要探究浓度对化学反应速率的影响,应选择温度相同条件下的实验;探究温度对化学反应速率的影响,应选择浓度相同条件下的实验;依据化学方程式写出离子方程式.
解答:
解:(1)2克乙炔完全燃烧生成液态水和CO2,放出99.6KJ热量,则26g(1mol)乙炔燃烧生成液态水和CO2,放出的热量为:1294.8KJ,所以其燃烧热△H=-1294.8KJ/mol,依据26g(1mol)乙炔燃烧生成液态水和CO2,放出的热量为:1294.8KJ,可知2摩尔乙炔完全燃烧放出的热量是2589.6KJ;
故答案为:-1294.8KJ/mol;2589.6KJ;
(2)乙二酸与乙二醇反应生成六元环状酯的方程式: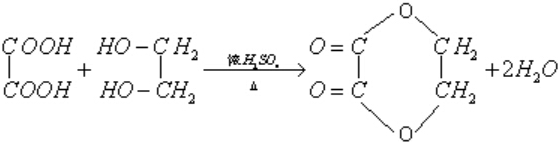 ,
,
故答案为: ;
;
(3)要探究浓度对化学反应速率的影响,应选择温度相同条件下的实验,所以应选择①②和③④;探究温度对化学反应速率的影响,应选择浓度相同条件下的实验,所以应选择①④;Na2S2O3+H2SO4═Na2SO4+S↓+SO2+H2O,反应的离子方程式为:S2O32-+2H+═S↓+SO2↑+H2O,
故答案为:①②和③④;①④;S2O32-+2H+═S↓+SO2↑+H2O.
故答案为:-1294.8KJ/mol;2589.6KJ;
(2)乙二酸与乙二醇反应生成六元环状酯的方程式:
 ,
,故答案为:
 ;
;(3)要探究浓度对化学反应速率的影响,应选择温度相同条件下的实验,所以应选择①②和③④;探究温度对化学反应速率的影响,应选择浓度相同条件下的实验,所以应选择①④;Na2S2O3+H2SO4═Na2SO4+S↓+SO2+H2O,反应的离子方程式为:S2O32-+2H+═S↓+SO2↑+H2O,
故答案为:①②和③④;①④;S2O32-+2H+═S↓+SO2↑+H2O.
点评:本题考查了燃烧热的概念和计算,化学方程式、离子方程式的书写、实验条件的选择,题目综合性较强,难度中等,注意反应热指1mol物质,生成的必须是稳定的氧化物.

练习册系列答案
相关题目
 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律.