题目内容
下表为元素周期表中的一部分,用化学式或元素符号回答下列问题:
(1)10种元素中,化学性质最不活泼的是 ;
(2)④②⑤中,最高价氧化物的水化物,碱性最强的碱是 ;
(3)②③④中形成的简单离子,半径由大到小的顺序是 ;
(4)写出元素⑥与⑦形成的化合物的电子式 ;该物质的分子构型为 型.
(5)利用电子式来表示①与⑦形成的最简单化合物的形成过程 .
(6)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为
(7)试比较与⑦与⑧两种元素最简单氢化物的沸点高低 .
| 族 周期 |
I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑧ | ||||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)④②⑤中,最高价氧化物的水化物,碱性最强的碱是
(3)②③④中形成的简单离子,半径由大到小的顺序是
(4)写出元素⑥与⑦形成的化合物的电子式
(5)利用电子式来表示①与⑦形成的最简单化合物的形成过程
(6)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为
(7)试比较与⑦与⑧两种元素最简单氢化物的沸点高低
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是Na、K、Mg、Ca、Al、C、S、O、Br、Ar元素
(1)稀有气体元素化学性质最不活泼;
(2)元素的金属性越强,其最高价氧化物的水化物的碱性越强;
(3)离子的电子层数越多其离子半径越大,电子层结构相同的离子其离子半径随着原子序数的增大而减小;
(4)元素⑥与⑦形成的化合物是CS2,其结构和CO2相似,根据CO2电子式书写CS2电子式;该物质的分子构型和CO2相同;
(5)①与⑦通过得失电子生成Na2S;
(6)①和⑤最高价氧化物对应的水化物分别是NaOH、Al(OH)3,二者相互反应生成偏铝酸钠和水;
(7)同一主族元素,其氢化物的沸点随着原子序数的增大而呈增大趋势,但含有氢键的氢化物沸点更高.
(1)稀有气体元素化学性质最不活泼;
(2)元素的金属性越强,其最高价氧化物的水化物的碱性越强;
(3)离子的电子层数越多其离子半径越大,电子层结构相同的离子其离子半径随着原子序数的增大而减小;
(4)元素⑥与⑦形成的化合物是CS2,其结构和CO2相似,根据CO2电子式书写CS2电子式;该物质的分子构型和CO2相同;
(5)①与⑦通过得失电子生成Na2S;
(6)①和⑤最高价氧化物对应的水化物分别是NaOH、Al(OH)3,二者相互反应生成偏铝酸钠和水;
(7)同一主族元素,其氢化物的沸点随着原子序数的增大而呈增大趋势,但含有氢键的氢化物沸点更高.
解答:
解:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是Na、K、Mg、Ca、Al、C、S、O、Br、Ar元素
(1)稀有气体元素化学性质最不活泼,则这些元素中化学性质最不活泼的是Ar,故答案为:Ar;
(2)元素的金属性越强,其最高价氧化物的水化物的碱性越强,这几种元素中金属性强弱顺序是K>Ca>Al,所以金属元素最高价氧化物的水化物碱性最强的是KOH,故答案为:KOH;
(3)离子的电子层数越多其离子半径越大,电子层结构相同的离子其离子半径随着原子序数的增大而减小,②③④中形成的简单离子,钾离子和钙离子电子层结构相同,镁离子电子层数最少,所以这几种简单离子半径大小顺序是K+>Ca2+>Mg2+,故答案为:K+>Ca2+>Mg2+;
(4)元素⑥与⑦形成的化合物是CS2,其结构和CO2相似,根据CO2电子式书写CS2电子式为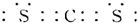 ;该物质的分子构型和CO2相同,所以二硫化碳为直线形分子,故答案为:
;该物质的分子构型和CO2相同,所以二硫化碳为直线形分子,故答案为: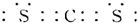 ;直线;
;直线;
(5)①与⑦通过得失电子生成Na2S,用电子式表示其过程为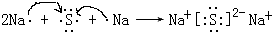 ,
,
故答案为: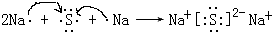 ;
;
(6)①和⑤最高价氧化物对应的水化物分别是NaOH、Al(OH)3,二者相互反应生成偏铝酸钠和水,反应方程式为NaOH+Al(OH)3=NaAlO2+2H2O,
故答案为:NaOH+Al(OH)3=NaAlO2+2H2O;
(7)同一主族元素,其氢化物的沸点随着原子序数的增大而呈增大趋势,但含有氢键的氢化物沸点更高,水中含有氢键、H2S中不含氢键,所以沸点H2O>H2S,
故答案为:H2O>H2S.
(1)稀有气体元素化学性质最不活泼,则这些元素中化学性质最不活泼的是Ar,故答案为:Ar;
(2)元素的金属性越强,其最高价氧化物的水化物的碱性越强,这几种元素中金属性强弱顺序是K>Ca>Al,所以金属元素最高价氧化物的水化物碱性最强的是KOH,故答案为:KOH;
(3)离子的电子层数越多其离子半径越大,电子层结构相同的离子其离子半径随着原子序数的增大而减小,②③④中形成的简单离子,钾离子和钙离子电子层结构相同,镁离子电子层数最少,所以这几种简单离子半径大小顺序是K+>Ca2+>Mg2+,故答案为:K+>Ca2+>Mg2+;
(4)元素⑥与⑦形成的化合物是CS2,其结构和CO2相似,根据CO2电子式书写CS2电子式为
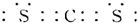 ;该物质的分子构型和CO2相同,所以二硫化碳为直线形分子,故答案为:
;该物质的分子构型和CO2相同,所以二硫化碳为直线形分子,故答案为: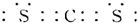 ;直线;
;直线;(5)①与⑦通过得失电子生成Na2S,用电子式表示其过程为
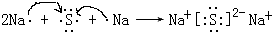 ,
,故答案为:
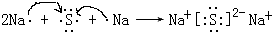 ;
;(6)①和⑤最高价氧化物对应的水化物分别是NaOH、Al(OH)3,二者相互反应生成偏铝酸钠和水,反应方程式为NaOH+Al(OH)3=NaAlO2+2H2O,
故答案为:NaOH+Al(OH)3=NaAlO2+2H2O;
(7)同一主族元素,其氢化物的沸点随着原子序数的增大而呈增大趋势,但含有氢键的氢化物沸点更高,水中含有氢键、H2S中不含氢键,所以沸点H2O>H2S,
故答案为:H2O>H2S.
点评:本题考查了元素周期表和元素周期律的综合应用,涉及电子式的书写、氢键、分子构型的判断、元素周期律等知识点,这些知识点都是考试热点,根据电子式的书写特点、氢键对物质性质的影响等知识点再结合元素周期律、知识迁移的方法分析解答即可,题目难度不大.

练习册系列答案
相关题目
1000℃时,FeO(s)+H2?Fe(s)+H2O,K=0.52.欲使容器中有1.0mol FeO被还原,反应前容器中应充入a mol H2.则a最接近( )
| A、1.0 | B、2.0 |
| C、3.0 | D、4.0 |
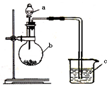 已知:元素最高价氧化物对应的水化物酸性越强,元素原子的得电子能力越强.某化学兴趣小组同学为了验证硫与碳的得电子能力的强弱,用如图所示装置设计实验.根据要求回答问题:
已知:元素最高价氧化物对应的水化物酸性越强,元素原子的得电子能力越强.某化学兴趣小组同学为了验证硫与碳的得电子能力的强弱,用如图所示装置设计实验.根据要求回答问题: A、B、C、D、E为5种短周期元素,相对位置如图:
A、B、C、D、E为5种短周期元素,相对位置如图: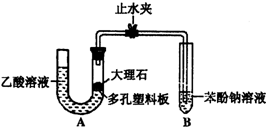 某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.
某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.