题目内容
12.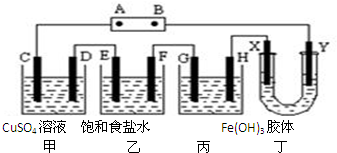 将下列装置如图连接,D、F、X、Y、E 都是铂电极,C是铁电极.甲,乙,丙三个装置中电解前后溶液的体积都是500mL.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.下列说法不正确的是( )
将下列装置如图连接,D、F、X、Y、E 都是铂电极,C是铁电极.甲,乙,丙三个装置中电解前后溶液的体积都是500mL.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.下列说法不正确的是( )| A. | 电源B 极的名称是负极,丁中Y极附近颜色变深 | |
| B. | 乙装置中电解一段时间后,加入0.2mol盐酸则可以恢复原来的浓度 | |
| C. | 设甲池中溶液的体积在电解前后都是500ml,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为0.2mol/L | |
| D. | 甲装置中电解反应的总化学方程式是:CuSO4+Fe$\frac{\underline{\;电解\;}}{\;}$Cu+FeSO4 |
分析 A.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色,说明F极有NaOH生成,则F为阴极,E为阳极,电源A为正极、B为负极,氢氧化铁胶体胶粒带正电荷,向阴极移动;
B.乙中电解反应的总化学方程式是:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH,相当于析出HCl气体,应加入为氢气或氯气物质的量2倍的HCl气体,可以恢复原溶液浓度;
C.甲装置中,C为阳极,电极反应式为Fe-2e-=Fe2+,D为阴极,电极反应式为:Cu2++2e-=Cu,电解反应的总化学方程式是:CuSO4+Fe$\frac{\underline{\;电解\;}}{\;}$Cu+FeSO4,
乙中产生气体为氢气、氯气,二者物质的量之比为1:1,计算氯气物质的量,根据电子转移守恒计算甲中生成FeSO4的物质的量,进而计算其浓度;
D.由C中分析可知,甲装置中电解反应的总化学方程式是:CuSO4+Fe$\frac{\underline{\;电解\;}}{\;}$Cu+FeSO4.
解答 解:A.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色,说明F极有NaOH生成,则F为阴极,E为阳极,电源A为正极、B为负极,丁中Y连接电源负极,则Y为阴极,X为阳极,氢氧化铁胶体胶粒带正电荷,向阴极移动,故A正确;
B.乙中电解反应的总化学方程式是:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH,相当于析出HCl气体,由于反应中物质的有关具体量未知,不能确定加入HCl物质的量,且盐酸含有水,故B错误;
C.甲装置中,C为阳极,电极反应式为Fe-2e-=Fe2+,D为阴极,电极反应式为:Cu2++2e-=Cu,电解反应的总化学方程式是:CuSO4+Fe$\frac{\underline{\;电解\;}}{\;}$Cu+FeSO4,
乙中产生气体为氢气、氯气,二者物质的量之比为1:1,则氯气物质的量为$\frac{4.48L}{22.4L/mol}$×$\frac{1}{2}$=0.1mol,根据电子转移守恒,甲中生成FeSO4的物质的量为$\frac{0.1mol×2}{2}$=0.1mol,FeSO4的物质的量浓度为$\frac{0.1mol}{0.5L}$=0.2mol/L,故C正确;
D.由C中分析可知,甲装置中电解反应的总化学方程式是:CuSO4+Fe$\frac{\underline{\;电解\;}}{\;}$Cu+FeSO4,故D正确,
故选:B.
点评 本题考查电解原理,能正确判断电解池的阴阳极是解本题的关键,理解掌握离子放电顺序,难度中等.

| A. | 石油裂解、海水制镁、纤维素制火棉都包含化学变化 | |
| B. | 蛋白质、棉花、聚氯乙烯、淀粉都是自然界存在的天然高分子化合物 | |
| C. | 2013年诺贝尔化学奖授予三位美国化学家,以表彰他们设计出多尺度复杂化学系统模型,将传统化学实验搬到了网络世界,这一完美结合现实与理论的化学系统模型,为全面了解并预测化学反应进程奠定了基础 | |
| D. | 一些有机溶剂(如乙醚、乙醇、苯、丙酮等)沸点低极易被引燃,加热时最好用水浴加热 |
| A. | 至少存在5种离子 | |
| B. | SO42ˉ、NH4+一定存在,Clˉ可能不存在 | |
| C. | Clˉ一定存在,且c(Clˉ)≥0.3mol/L | |
| D. | CO32ˉ、Al3+一定不存在,K+可能存在 |
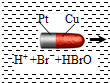 一种子弹头形的纳米铜铂电池,它在稀溴水中能沿着铜极方向移动(如图),电池反应为:Cu+Br2=CuBr2.下列说法正确的是( )
一种子弹头形的纳米铜铂电池,它在稀溴水中能沿着铜极方向移动(如图),电池反应为:Cu+Br2=CuBr2.下列说法正确的是( )| A. | 铜为电池的正极 | |
| B. | 铂不断溶解 | |
| C. | 稀溴水为电解质溶液 | |
| D. | 电池工作时实现机械能向电能再向化学能转化 |
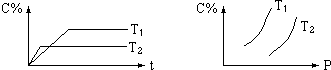
| A. | T1<T2 | B. | m+n<e | ||
| C. | 正反应是吸热反应 | D. | 逆反应是放热反应 |
| A. | CH3CH═CH2和 | B. | 乙炔和苯 | C. |  和 和 | D. | 苯和苯酚 |
| A. | 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于侧链与苯环的相互影响,使侧链和苯环均易被氧化 | |
| B. | 等质量的乙烷、乙烯、乙炔在氧气中完全燃烧,乙烷消耗的氧气最多 | |
| C. | 间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构 | |
| D. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
 现有FeCl3、AlCl3的混合溶液250mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图所示,则混合液中FeCl3的物质的量浓度是( )
现有FeCl3、AlCl3的混合溶液250mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图所示,则混合液中FeCl3的物质的量浓度是( )| A. | 0.4 mol/L | B. | 1.8 mol/L | C. | 1.6 mol/L | D. | 1.2 mol/L |
| A. | 3.10 mL | B. | (50-3.10)mL | C. | 大于(50-3.10)mL | D. | 大于3.10mL |