题目内容
4.下列有关物质的性质或应用的说法正确的是( )| A. | 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于侧链与苯环的相互影响,使侧链和苯环均易被氧化 | |
| B. | 等质量的乙烷、乙烯、乙炔在氧气中完全燃烧,乙烷消耗的氧气最多 | |
| C. | 间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构 | |
| D. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
分析 A.甲苯被高锰酸钾氧化生成苯甲酸,苯环影响甲基;
B.等质量的烃燃烧,耗氧量取决于H%,H%越大耗氧量越大;
C.邻二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构;
D.石油裂解可以得到甲烷和乙烯,苯可通过煤的干馏获得.
解答 解:A.由现象可知,甲苯被高锰酸钾氧化生成苯甲酸,因苯环影响甲基,为苯环对侧链的影响,而苯环不能被氧化,故A错误;
B.等质量的烃燃烧,耗氧量取决于H%,H%越大耗氧量越大,乙烷的含氢量最大,则消耗的氧气的量最多,故B正确;
C.无论苯环是否为单双键交替的结构,间二溴苯都只有一种结构,则间二溴苯仅有一种空间结构不能证明苯分子中不存在单双键交替的结构,故C错误;
D.石油的分馏不能得到甲烷、乙烯等,只能的到汽油、煤油、柴油等轻质油和重油,然后轻质油再经过裂解可以得到甲烷、乙烯等小分子烃,煤的干馏产品中含苯,故D错误;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,选项D为易错点,注意有机物结构分析及干馏、蒸馏、分馏、裂化、裂解等概念为易混淆的知识点,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
14.某固体混合物,可能含有FeCl2、NaNO2、Ba(OH)2、AlCl3、Na2SO3中的若干种.取适量该混合物加适量水充分搅拌,得到白色沉淀A与无色溶液B.
①取适量A加入稀硝酸至过量,白色沉淀部分溶解
②取少量B逐滴加入稀硫酸至过量,不断生成白色沉淀后沉淀部分溶解
③取少量B滴加酸性高锰酸钾溶液,振荡,最终得无色溶液
根据上述实验现象,以下推测正确的是( )
①取适量A加入稀硝酸至过量,白色沉淀部分溶解
②取少量B逐滴加入稀硫酸至过量,不断生成白色沉淀后沉淀部分溶解
③取少量B滴加酸性高锰酸钾溶液,振荡,最终得无色溶液
根据上述实验现象,以下推测正确的是( )
| A. | 无法判断固体中FeCl2是否存在 | |
| B. | ③中使高锰酸钾溶液褪色的是亚硝酸根离子 | |
| C. | B的pH<7 | |
| D. | 固体由Ba(OH)2、AlCl3、Na2SO3组成 |
12.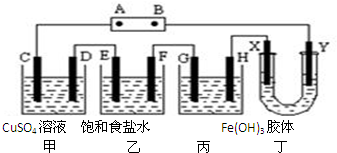 将下列装置如图连接,D、F、X、Y、E 都是铂电极,C是铁电极.甲,乙,丙三个装置中电解前后溶液的体积都是500mL.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.下列说法不正确的是( )
将下列装置如图连接,D、F、X、Y、E 都是铂电极,C是铁电极.甲,乙,丙三个装置中电解前后溶液的体积都是500mL.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.下列说法不正确的是( )
 将下列装置如图连接,D、F、X、Y、E 都是铂电极,C是铁电极.甲,乙,丙三个装置中电解前后溶液的体积都是500mL.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.下列说法不正确的是( )
将下列装置如图连接,D、F、X、Y、E 都是铂电极,C是铁电极.甲,乙,丙三个装置中电解前后溶液的体积都是500mL.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.下列说法不正确的是( )| A. | 电源B 极的名称是负极,丁中Y极附近颜色变深 | |
| B. | 乙装置中电解一段时间后,加入0.2mol盐酸则可以恢复原来的浓度 | |
| C. | 设甲池中溶液的体积在电解前后都是500ml,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为0.2mol/L | |
| D. | 甲装置中电解反应的总化学方程式是:CuSO4+Fe$\frac{\underline{\;电解\;}}{\;}$Cu+FeSO4 |
19.欲配制100mL 1.0mol•L-1Na2SO4溶液,正确的方法是( )
①将14.2g Na2SO4溶于100mL水中
②将32.2gNa2SO4•10H2O溶于少量水 中,再用水稀释至100mL
③将20mL 5.0mol•L-1Na2SO4溶液用水稀释至100mL.
①将14.2g Na2SO4溶于100mL水中
②将32.2gNa2SO4•10H2O溶于少量水 中,再用水稀释至100mL
③将20mL 5.0mol•L-1Na2SO4溶液用水稀释至100mL.
| A. | ①② | B. | ②③ | C. | ① | D. | ①②③ |
9.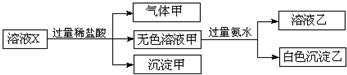 水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子.某同学对该溶液进行了如图实验:下列判断正确的是( )
水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子.某同学对该溶液进行了如图实验:下列判断正确的是( )
 水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子.某同学对该溶液进行了如图实验:下列判断正确的是( )
水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子.某同学对该溶液进行了如图实验:下列判断正确的是( )| A. | 沉淀甲不一定是纯净物 | |
| B. | 溶液中一定有Al3+和CO32-和SiO32- | |
| C. | K+、AlO2-和SiO32-一定存在于溶液X中 | |
| D. | CO32-和SO42-一定不存在于溶液X中 |
16.现有氧化铝、石灰石、二氧化硅三种白色粉末,若用一种试剂将它们区别开来,此试剂是( )
| A. | 水 | B. | 盐酸 | C. | 氢氧化钠溶液 | D. | 硝酸银溶液 |
13.下列关于钠的叙述错误的是( )
| A. | 实验后剩余少量钠可放回原试剂瓶中 | |
| B. | 用一般的化学还原法不能制取金属钠 | |
| C. | 某物质的焰色反应为黄色,则该物质一定含钠元素 | |
| D. | 钠可以用少量水密封保存 |
14.下列物质除杂(括号内物质为杂质)所用试剂正确的是( )
| 物 质 | 试 剂 | |
| A | Na2SO4溶液(NaBr) | Cl2 |
| B | FeCl2 溶液(FeCl3) | Cu |
| C | CO2(CO) | 通入O2燃烧 |
| D | CO2(HCl) | 饱和NaHCO3溶液 |
| A. | A | B. | B | C. | C | D. | D |