题目内容
8.下列叙述正确的是( )| A. | 同主族元素自上而下,得电子能力增强 | |
| B. | 最外层电子数小于4的一定是金属元素 | |
| C. | 同周期元素中ⅠA族元素的原子半径最小 | |
| D. | 非金属:Cl>S>P |
分析 元素周期表中,同周期原子从左向右原子半径减小、非金属性增强;同主族从上到下金属性增强、非金属性减弱,结合H为非金属性来解答.
解答 解:A.同主族元素自上而下,非金属性减弱,则得电子能力减弱,故A错误;
B.最外层电子数小于4的不一定是金属元素,如H、He均为非金属,故B错误;
C.同周期原子从左向右原子半径减小,则同周期元素中ⅠA族元素的原子半径最大,故C错误;
D.同周期原子从左向右非金属性增强,则非金属:Cl>S>P,故D正确;
故选D.
点评 本题考查元素周期表的结构与应用,为高频考点,把握元素的位置、元素的性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
18.设NA表示阿伏加德罗常数,下列叙述中不正确的是( )
| A. | 1 mol H2O所含有的原子数为3NA | |
| B. | 常温常压下,32g O2含有的氧原子数为2NA | |
| C. | 11.2L氯气所含的原子数为NA | |
| D. | 0.1mol•L -1NaCl溶液中c(Na+)为0.1 mol•L -1 |
19.下列各组化合物中,化学键的类型完全相同的是( )
| A. | CaCl2和Na2S | B. | Na2O和Na2O2 | C. | CO2和NaCl | D. | HCl和NaOH |
16.不属于“氮的固定”的变化是( )
| A. | 豆科植物的根瘤菌固氮 | B. | .由氮气和氢气合成氨气 | ||
| C. | .雷雨天,空气中的氮气和氧气反应 | D. | .氨催化氧化制硝酸 |
13.运用元素周期律分析下面的推断,其中不正确的是( )
| A. | 硒化氢(H2Se)是有色、有毒的气体,比H2S稳定 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | 硫酸锶(SrSO4)是难溶于水的白色固体 |
17.下列化合物中,既含有离子键又含有共价键的是( )
| A. | H2O2 | B. | Na2O | C. | CO2 | D. | NaOH |
2.用菱锌矿(主要成分为碳酸锌,还含有Fe2+、Fe3+、Mg2+、Ca2+、Cu2+等)制备氯化锌的流程如图.
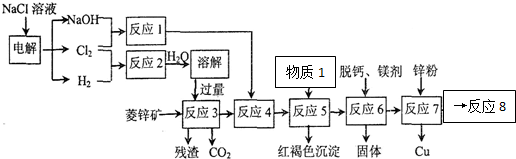
(1)电解饱和食盐水,H2在阴极生成
(2)在反应3前要将菱锌矿研磨,其目的是增大反应物的接触面积,加快反应速率,提高浸取率
(3)反应4的目的:将Fe2+氧化为Fe3+
(4)物质1最佳选用:C(填符号),调节pH至3.2-6.4(填范围),目的是将Fe3+完全转化为Fe(OH)3除去
A.NH3•H2O B.NaOH C.ZnO
(5)反应8从溶液中获得ZnCl2,加热前需通入足量的HCl气体,目的抑制Zn2+(ZnCl2)的水解.

| 离子 | 开始沉淀时的PH | 完全沉淀时的PH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.5 | 9.7 |
| Zn2+ | 6.4 | 8.0 |
(2)在反应3前要将菱锌矿研磨,其目的是增大反应物的接触面积,加快反应速率,提高浸取率
(3)反应4的目的:将Fe2+氧化为Fe3+
(4)物质1最佳选用:C(填符号),调节pH至3.2-6.4(填范围),目的是将Fe3+完全转化为Fe(OH)3除去
A.NH3•H2O B.NaOH C.ZnO
(5)反应8从溶液中获得ZnCl2,加热前需通入足量的HCl气体,目的抑制Zn2+(ZnCl2)的水解.