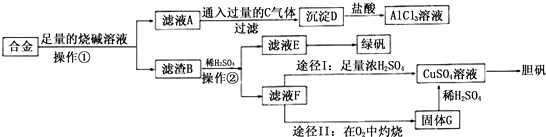
题目内容
19.下列各组化合物中,化学键的类型完全相同的是( )| A. | CaCl2和Na2S | B. | Na2O和Na2O2 | C. | CO2和NaCl | D. | HCl和NaOH |
分析 一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,以此来解答.
解答 解:A.均只含离子键,故A选;
B.Na2O只含离子键,Na2O2含离子键和共价键,故B不选;
C.CO2含共价键,NaCl含离子键,故C不选;
D.HCl含共价键,NaOH中含离子键和共价键,故D不选;
故选A.
点评 本题考查化学键,为高频考点,把握官化学键的形成及判断的一般规律等为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.

练习册系列答案
相关题目
9.下列反应中,不属于取代反应的是( )
| A. | 在催化剂存在条件下苯与溴反应制溴苯 | |
| B. | 苯与浓硝酸、浓硫酸混合共热制取硝基苯 | |
| C. | 在催化剂存在条件下,乙烯与氯化氢反应制氯乙烷 | |
| D. | 葡萄糖与银氨溶液反应 |
7.下列离子中半径最大的是( )
| A. | O2? | B. | F- | C. | Mg2+ | D. | Al3+ |
11.将14Si的电子排布式写成1S22S22P63S23P2X,它违背了( )
| A. | 构造原理 | B. | 泡利原理 | C. | 洪特规则 | D. | 能量守恒原理 |
8.下列叙述正确的是( )
| A. | 同主族元素自上而下,得电子能力增强 | |
| B. | 最外层电子数小于4的一定是金属元素 | |
| C. | 同周期元素中ⅠA族元素的原子半径最小 | |
| D. | 非金属:Cl>S>P |
9.NA为阿伏伽德罗常数,下列有关说法正确的是( )
| A. | 78g过氧化钠晶体中,含2NA个阴离子 | |
| B. | 足量的铜与含2molH2SO4的浓硫酸充分反应,可生成NA个SO2分子 | |
| C. | 工业上铜的电解精炼时电解池中每转移1mol电子时阳极上溶解的铜原子数为0.5NA | |
| D. | 3mol铁与足量的水蒸气充分反应,转移电子8NA个 |
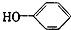 合成
合成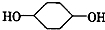 (部分试剂和反应条件已略去)
(部分试剂和反应条件已略去)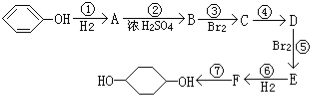
 ;F中含有官能团的名称为溴原子.
;F中含有官能团的名称为溴原子.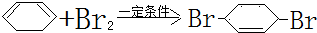 ,写出在同样反应条件下
,写出在同样反应条件下 的化学方程式(有机物写结构简式,注明反应条件)
的化学方程式(有机物写结构简式,注明反应条件)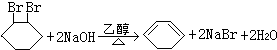 .
.