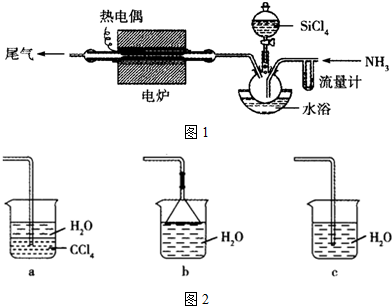
题目内容
14.下列离子方程式书写正确的是( )| A. | NaAl(SO4)2溶液中滴加Ba(OH)2直至SO42-沉淀完全:2Al3++6OH-+3SO42-+3Ba2+=2Al(OH)3↓+3BaSO4↓ | |
| B. | NH4HS溶液与少量的NaOH溶液反应:NH4++OH-=NH3•H2O | |
| C. | 稀H2SO4和Na2S2O3溶液共热:S2O32-+2H+$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+S↓+H2O | |
| D. | 过量Cl2通入Fel2溶液中:3Cl2+2I-+4Fe2+=4Cl-+I2+4Fe3+ |
分析 A.硫酸根离子完全沉淀时,铝离子与氢氧根离子按照物质的量1:4反应生成偏铝酸根离子;
B.少量的NaOH先和HS-反应,而非先与NH4+反应;
C.酸性条件下Na2S2O3与氢离子发生反应生成二氧化硫气体和硫单质;
D.氯气过量,亚铁离子和碘离子都完全反应.
解答 解:A.NaAl(SO4)2溶液中滴加Ba(OH)2直至SO42-沉淀完全,铝离子完全反应生成偏铝酸根离子,正确的离子方程式为:Al3++4OH-+2SO42-+2Ba2+=AlO2-+2BaSO4↓+2H2O,故A错误;
B.NH4HS溶液与少量的NaOH溶液反应,HS-优先反应,正确的离子方程式为:HS-+OH-=S2-=H2O,故B错误;
C.稀H2SO4和Na2S2O3溶液共热,反应生成硫酸钠、水、二氧化硫和S,反应的离子方程式为:S2O32-+2H+$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+S↓+H2O,故C正确;
D.过量Cl2应氧化完所有的I-和Fe2+,且满足二者之比为2:1,不可能有1:2的情景,正确的离子方程式为:3Cl2+4I-+2Fe2+=6Cl-+2I2+2Fe3+,故D错误;
故选C.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等;A为易错点,注意反应物过量情况对生成物的影响.

练习册系列答案
相关题目
4.已知:CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l),1mol CH3CH2CH2CH3完全燃烧放出 2878kJ热量;(CH3)2CHCH3(g)+6.5O2(g)→4CO2(g)+5H2O(l),1mol(CH3)2CHCH3燃烧放出2869kJ热量.下列说法正确的是( )
| A. | 1 mol CH3CH2CH2CH3分子储存的能量大于1 mol (CH3)2CHCH3分子 | |
| B. | 1 mol CH3CH2CH2CH3分子储存的能量小于1 mol (CH3)2CHCH3分子 | |
| C. | (CH3)2CHCH3转化为CH3CH2CH2CH3的过程是一个放热过程 | |
| D. | 断开1 mol物质中化学键吸收的能量CH3CH2CH2CH3大于(CH3)2CHCH3 |
2.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 25℃时,0.1mol/L pH=4.5的NaHC2O4溶液:c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| B. | NaHCO3溶液:c(OH-)=c(H+)+c(H2CO3-)-c(CO32-) | |
| C. | 25℃时,pH=9、浓度均为0.1 mol/L的NH3•H2O、NH4Cl混合溶液:c(NH4+)+c(H+)>c(NH3•H2O)+c(OH-) | |
| D. | 0.1mol/L(NH4)2Fe(SO4)2溶液中:c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
19.含有3.01×1023个O原子的H3PO4中,H原子的物质的量为( )
| A. | 1mol | B. | 0.5mol | C. | 0.25mol | D. | 0.375mol |
18.把1L含乙烯和H2的混合气体通过Ni催化剂,使乙烯和H2发生加成反应,完全反应后,气体体积变为yL(气体体积均在同温、同压下测定).若乙烯在1L混合气体中的体积分数为a%,则a%和y的关系一定不正确的是( )
| A. | y=1×a% | B. | y=1-1×a% | C. | y=1×a%=0.5 | D. | y=1-1×a%<0.5 |
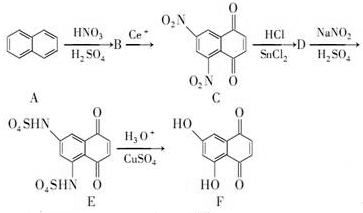
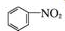 +SnCl2$\stackrel{HCl}{→}$
+SnCl2$\stackrel{HCl}{→}$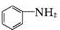 +SnCl4
+SnCl4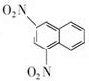 .
.