题目内容
水的电离平衡曲线如图所示,下列说法不 正确的是( )
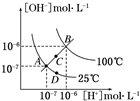

| A、图中四点KW间的关系:A=D<C<B |
| B、若从A点到C点,可采用温度不变在水中加少量CH3COONa固体 |
| C、若从A点到D点,可采用温度不变在水中加少量酸 |
| D、若处在B点所在的温度,将pH=2的硫酸与pH=10的NaOH的两种溶液等体积混合后,溶液显中性 |
考点:离子积常数
专题:
分析:A.A、D都处于25℃时,Kw相等,然后比较B、C两点的c(H+)和c(OH-)的大小,依此比较Kw的大小;
B.从A点到C点c(H+)和c(OH-)的变化以及Kw只受温度影响来分析;
C.从A点到D点c(H+)变大,但c(OH-)变小,温度不变,Kw不变;
D.根据B点时Kw计算酸与碱溶液中c(H+)和c(OH-),然后判断溶液的酸碱性.
B.从A点到C点c(H+)和c(OH-)的变化以及Kw只受温度影响来分析;
C.从A点到D点c(H+)变大,但c(OH-)变小,温度不变,Kw不变;
D.根据B点时Kw计算酸与碱溶液中c(H+)和c(OH-),然后判断溶液的酸碱性.
解答:
解:A.AD都处于25℃时,Kw相等,B点c(H+)和c(OH-)都大于C点的c(H+)和c(OH-),C点的c(H+)和c(OH-)大于A点c(H+)和c(OH-),c(H+)和c(OH-)越大,Kw越大,故A=D<C<B,故A正确;
B.若从A点到C点,c(H+)变大,c(OH-)变大,Kw增大,温度应升高,但在25℃时在水中加入少量CH3COONa固体,c(H+)变小,c(OH-)变大,Kw不变,故B错误;
C.加酸,c(H+)变大,但c(OH-)变小,但温度不变,故C正确;
D.B点所在的温度,Kw=c(H+)×c(OH-)=10-12,若处在B点时,pH=2的硫酸中c(H+)=10-2mol/L,pH=10的KOH中c(OH-)=
=10-2mol/L,溶液显中性,故D正确;
故选B.
B.若从A点到C点,c(H+)变大,c(OH-)变大,Kw增大,温度应升高,但在25℃时在水中加入少量CH3COONa固体,c(H+)变小,c(OH-)变大,Kw不变,故B错误;
C.加酸,c(H+)变大,但c(OH-)变小,但温度不变,故C正确;
D.B点所在的温度,Kw=c(H+)×c(OH-)=10-12,若处在B点时,pH=2的硫酸中c(H+)=10-2mol/L,pH=10的KOH中c(OH-)=
| 10-12 |
| 10-10 |
故选B.
点评:本题考查水的电离平衡移动问题,题目难度中等,结合图象判断并分析溶液在不同温度下的Kw,做题时注意根据图象比较c(H+)和c(OH-)的大小.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
 食品安全是近期的焦点问题.苏丹红是一种工业合成染色剂,但却被滥用作食品的着色剂,严重危害了人们的身体健康.苏丹红1(sudan 1)的结构简式如图,有关它的叙述不正确的是( )
食品安全是近期的焦点问题.苏丹红是一种工业合成染色剂,但却被滥用作食品的着色剂,严重危害了人们的身体健康.苏丹红1(sudan 1)的结构简式如图,有关它的叙述不正确的是( )| A、可与FeCl3溶液发生显色反应 |
| B、1mol该物质可与1mol Br2发生取代反应 |
| C、其分子式为C16H12N2O |
| D、该物质极易溶于水 |
下列各现象不能用平衡移动原理解释的是( )
| A、FeS 不溶于水,但能溶于稀盐酸中 |
| B、CaCO3难溶于稀硫酸中,却能溶于醋酸中 |
| C、分别用等体积的蒸馏水和稀硫酸洗涤BaSO4沉淀,用水洗涤造成BaSO4的损失量大于用稀硫酸造成的损失量 |
| D、Cl2 与 Na2S 溶液反应生成单质 S 沉淀 |
下列叙述错误的是( )
| A、在加热搅拌条件下加入MgO,可除去MgCl2溶液中的Fe3+ |
| B、pH=4.5的番茄汁中c(H+ )是pH=6.5的牛奶中c(H+)的100倍 |
| C、常温下,CH3COONa和CH3COOH的混合溶液中(pH=7):C(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
| D、常温下,Cd(OH)2和Co(OH)2的混合悬浊液中,c(Cd2+)是c(Co2+)的3.5倍,已知:KSP(Cd(OH)2)=7.2×10-15,Ksp(Co(OH)2)=1.8×10-15 |

