题目内容
将250ml密度为1.1g/km3,质量分数为15%的H2SO4液与适量的Fe屑充分反应,计算:
①此硫酸中H2SO4的物质的量浓度
②生成H2的体积(标况)
③将生成的FeSO4配成400ml溶液,此溶液中FeSO4物质的量浓度.
①此硫酸中H2SO4的物质的量浓度
②生成H2的体积(标况)
③将生成的FeSO4配成400ml溶液,此溶液中FeSO4物质的量浓度.
考点:化学方程式的有关计算
专题:计算题
分析:①根据c=
,计算该硫酸的物质的量浓度;
②进行过量计算,根据不足量的物质计算生成氢气的体积;
③根据方程式计算生成硫酸亚铁的物质的量,再根据c=
计算.
| 1000ρw |
| M |
②进行过量计算,根据不足量的物质计算生成氢气的体积;
③根据方程式计算生成硫酸亚铁的物质的量,再根据c=
| n |
| V |
解答:
解:①c=
=
=1.68×10-9mol/L,
答:此硫酸中H2SO4的物质的量浓度为1.68×10-9mol/L;
②n(H2)=n(H2SO4)=1.68×10-9mol/L×250ml×10-3L/ml=4.2×10-11mol,所以V(H2)=4.2×10-11mol×22.4L/mol=9.43×10-10L,
答:生成H2的体积9.43×10-10L;
③n(FeSO4)=n(H2SO4)=
=1.05×10-10mol/L,答:FeSO4物质的量浓度为1.05×10-10mol/L;
| 1000ρw |
| M |
| 1000×1.1×10-9×15% |
| 98 |
答:此硫酸中H2SO4的物质的量浓度为1.68×10-9mol/L;
②n(H2)=n(H2SO4)=1.68×10-9mol/L×250ml×10-3L/ml=4.2×10-11mol,所以V(H2)=4.2×10-11mol×22.4L/mol=9.43×10-10L,
答:生成H2的体积9.43×10-10L;
③n(FeSO4)=n(H2SO4)=
| 4.2×10-11mol |
| 0.4L |
点评:本题考查化学反应的计算结合物质的量的转化,学生只要掌握相关量之间的转化关系,就可以迅速解题了.

练习册系列答案
相关题目
“纳米材料”是直径从几纳米至几十纳米的材料.如将“纳米材料”分散到液体分散剂中,所得混合物可能具有的性质是( )
| A、所得分散系极不稳定 |
| B、具有丁达尔效应 |
| C、不能透过滤纸 |
| D、以上性质都不具有 |
水的电离平衡曲线如图所示,下列说法不 正确的是( )
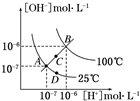

| A、图中四点KW间的关系:A=D<C<B |
| B、若从A点到C点,可采用温度不变在水中加少量CH3COONa固体 |
| C、若从A点到D点,可采用温度不变在水中加少量酸 |
| D、若处在B点所在的温度,将pH=2的硫酸与pH=10的NaOH的两种溶液等体积混合后,溶液显中性 |
下列有关物质性质的说法错误的是( )
| A、热稳定性:HCl>HI |
| B、原子半径:Na>Mg |
| C、酸性:H2SO3>H2SO4 |
| D、还原性:S2->Cl- |
下列化学方程式不正确的是( )
A、乙醇与浓氢溴酸反应:CH3CH2OH+HBr
| |||
B、溴乙烷与氢氧化钠溶液共热:CH3CH2HBr+NaOH
| |||
C、苯酚钠中通入二氧化碳2 +CO2+H2O→ +CO2+H2O→ +Na2CO3 +Na2CO3 | |||
D、蔗糖在稀硫酸作用下水解:C12H22O11(蔗糖)+H2O
|
 的正确命名是( )
的正确命名是( )| A、2,2-二乙基丁烷 |
| B、3-甲基-2-乙基戊烷 |
| C、2-乙基-3甲基-戊烷 |
| D、3,4-二甲基己烷 |
以2-丙醇为原料制取1,2-二溴丙烷,需要经过的反应是( )
| A、加成-消去 |
| B、取代一消去 |
| C、消去-取代 |
| D、消去-加成 |
 (1)火力发电厂时燃煤排烟中含有大量的氢氧化物(NOx),可利用甲烷和NOx在一定条件下反应消除其污染,写出CH4与NO2反应的化学方程式
(1)火力发电厂时燃煤排烟中含有大量的氢氧化物(NOx),可利用甲烷和NOx在一定条件下反应消除其污染,写出CH4与NO2反应的化学方程式 丙:分子式C9H8O,(部分性质,能使Br2/CCl4褪色 )由甲出发合成丙的路线之一如下:
丙:分子式C9H8O,(部分性质,能使Br2/CCl4褪色 )由甲出发合成丙的路线之一如下: