题目内容
回答下列与氯及其化合物有关的问题
(1)工业上用电解饱和食盐水的方法来制取氯气,请写出反应的化学方程式并用双线桥标出电子转移的方向和数目: .
(2)人们在日常生活当中常使用漂白液和漂白粉对环境和饮用水进行杀菌、消毒.漂白粉的有效成分是(填化学式) .
某研究性学习小组对漂白液进行了如下实验探究:取漂白液少量,滴入3~5滴紫色石蕊试液,发现溶液先变蓝色后褪色,可以证明漂白液具有的性质有 (填序号).
A.酸性 B.碱性 C.强氧化性 D.还原性
(3)二氧化氯是世卫组织确认的A级新型高效安全的消毒剂,其安全性远高于氯气.制备方法之一是:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O,当转移0.2mol电子时,参加反应的还原剂的物质的量为 .
(1)工业上用电解饱和食盐水的方法来制取氯气,请写出反应的化学方程式并用双线桥标出电子转移的方向和数目:
(2)人们在日常生活当中常使用漂白液和漂白粉对环境和饮用水进行杀菌、消毒.漂白粉的有效成分是(填化学式)
某研究性学习小组对漂白液进行了如下实验探究:取漂白液少量,滴入3~5滴紫色石蕊试液,发现溶液先变蓝色后褪色,可以证明漂白液具有的性质有
A.酸性 B.碱性 C.强氧化性 D.还原性
(3)二氧化氯是世卫组织确认的A级新型高效安全的消毒剂,其安全性远高于氯气.制备方法之一是:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O,当转移0.2mol电子时,参加反应的还原剂的物质的量为
考点:氯、溴、碘及其化合物的综合应用,氧化还原反应
专题:
分析:(1)电解饱和食盐水生成氢气、氯气和氢氧化钠,阳极生成氯气,阴极生成氢气;
(2)漂白粉的有效成分为Ca(ClO)2,滴入3~5滴紫色石蕊试液,发现溶液先变蓝色后褪色,说明具有碱性和氧化性;
(3)反应2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O中只有Cl元素化合价发生变化,NaClO3中Cl元素化合价由+5价降低到+4价,HCl中Cl元素化合价由-1价升高到0价.
(2)漂白粉的有效成分为Ca(ClO)2,滴入3~5滴紫色石蕊试液,发现溶液先变蓝色后褪色,说明具有碱性和氧化性;
(3)反应2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O中只有Cl元素化合价发生变化,NaClO3中Cl元素化合价由+5价降低到+4价,HCl中Cl元素化合价由-1价升高到0价.
解答:
解:(1)电解食盐水时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时生成氢氧化钠,反应的化学方程式以及电子转移的方向和数目可表示为 ,
,
故答案为: ;
;
(2)漂白粉的有效成分为Ca(ClO)2,滴入3~5滴紫色石蕊试液,发现溶液先变蓝色后褪色,说明具有碱性和氧化性,故答案为:Ca(ClO)2; BC;
(3)反应2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O中只有Cl元素化合价发生变化,NaClO3中Cl元素化合价由+5价降低到+4价,HCl中Cl元素化合价由-1价升高到0价,
当转移0.2mol电子时,有0.2molHCl被氧化,则参加反应的还原剂的物质的量为0.2mol,
故答案为:0.2mol.
 ,
,故答案为:
 ;
;(2)漂白粉的有效成分为Ca(ClO)2,滴入3~5滴紫色石蕊试液,发现溶液先变蓝色后褪色,说明具有碱性和氧化性,故答案为:Ca(ClO)2; BC;
(3)反应2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O中只有Cl元素化合价发生变化,NaClO3中Cl元素化合价由+5价降低到+4价,HCl中Cl元素化合价由-1价升高到0价,
当转移0.2mol电子时,有0.2molHCl被氧化,则参加反应的还原剂的物质的量为0.2mol,
故答案为:0.2mol.
点评:本题考查了电解食盐水的方程式、氧化剂和还原剂的判断等知识点,为高频考点,答题时注意审题,次氯酸钙要求写化学式,不能写文字,属于易错点.

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目
水的电离平衡曲线如图所示,下列说法不 正确的是( )
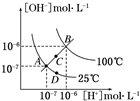

| A、图中四点KW间的关系:A=D<C<B |
| B、若从A点到C点,可采用温度不变在水中加少量CH3COONa固体 |
| C、若从A点到D点,可采用温度不变在水中加少量酸 |
| D、若处在B点所在的温度,将pH=2的硫酸与pH=10的NaOH的两种溶液等体积混合后,溶液显中性 |
 的正确命名是( )
的正确命名是( )| A、2,2-二乙基丁烷 |
| B、3-甲基-2-乙基戊烷 |
| C、2-乙基-3甲基-戊烷 |
| D、3,4-二甲基己烷 |
以2-丙醇为原料制取1,2-二溴丙烷,需要经过的反应是( )
| A、加成-消去 |
| B、取代一消去 |
| C、消去-取代 |
| D、消去-加成 |
在反应NaClO3+6HCl=NaCl+3Cl2+3H2O中,当生成0.5molCl2时,氧化产物和还原产物的物质的量之比为( )
| A、5:1 | B、3:1 |
| C、1:3 | D、1:5 |


 可用于制备涂料,其单体结构简式为
可用于制备涂料,其单体结构简式为 下列化合物:①HCl、②NaOH、③CH3COOH、④NH3?H2O、⑤CH3COONa、⑥NH4Cl
下列化合物:①HCl、②NaOH、③CH3COOH、④NH3?H2O、⑤CH3COONa、⑥NH4Cl