题目内容
(1)右图为固态氧化物燃料电池(SOFC)的原理示意图.试写出电极反应式:正极 ,负极 ;在导线中电子流动方向为a b(用“→”或“←”表示).该电池可选用的固态电解质为 (填字母)
A.ZrO(氧化锆) B.NaOH C.Na2SO4
此电池的工作温度一般应为 (填字母).
A.常温 B.约100℃C.约1000℃
(2)在电池反应中,每消耗0.5mol氧气,理论上能生成标准状况下CO2气体 L.
A.ZrO(氧化锆) B.NaOH C.Na2SO4

此电池的工作温度一般应为
A.常温 B.约100℃C.约1000℃
(2)在电池反应中,每消耗0.5mol氧气,理论上能生成标准状况下CO2气体
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)负极失电子,正极得电子,电子由负极移向正极,氧化锆有自由移动的O2-,据此分析解答;
(2)根据转移电子守恒,列关系式求解.
(2)根据转移电子守恒,列关系式求解.
解答:
解:(1)负极失电子:CO+O2--2e-=CO2,正极得电子:O2+4e-=2O2-,电子由负极移向正极,在导线中电子由a←b,氧化锆有自由移动的O2-,可做电解质,氧化锆高温下才发生电离,所以此电池的工作温度一般应为高温,故答案为:O2+4e-=2O2-;CO+O2--2e-=CO2;←; A;C;
(2)正极反应式为O2+4e-=2O2-,对比负极反应CO+O2--2e-=CO2可知,消耗1mol氧气生成2mol二氧化碳,标准状况下体积是44.8L,则每消耗0.5mol氧气,理论上能生成标准状况下CO2气体,故答案为:22.4.
(2)正极反应式为O2+4e-=2O2-,对比负极反应CO+O2--2e-=CO2可知,消耗1mol氧气生成2mol二氧化碳,标准状况下体积是44.8L,则每消耗0.5mol氧气,理论上能生成标准状况下CO2气体,故答案为:22.4.
点评:本题考查原电池反应(反应原理、电极方程式的书写、电子流动方向),难度不大,注意电解质的选择方法.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案
相关题目
甲醛、乙酸和丙醛(C3H6O)组成的混合物中,氧元素的质量分数37%,则碳元素的质量分数为( )
| A、27% | B、28% |
| C、54% | D、无法计算 |
氢化铝钠(NaAlH4)是最有研究应用前景的络合金属氢化物,氢化铝钠储放氢时发生反应:3NaAlH4
Na3AlH6+2Al+3H2↑.下列说法正确的是( )
| ||
| A、NaAlH4中含有离子键和非极性共价键 |
| B、每生成11.2 L(标准状况下)H2,转移NA个电子 |
| C、NaAlH4中氢元素为+1价,在反应中有50%的氢被还原 |
| D、反应中氧化产物与还原产物的物质的量之比为1:1 |
下列物质的俗称、主要成分的化学式及其用途均正确的是( )
| A、磁铁矿--Fe2O3--炼铁 |
| B、胆矾--CuSO4?5H2O--波尔多液 |
| C、蓝宝石--SiO2--饰品 |
| D、纯碱--NaHCO3--焙制糕点 |
水的电离平衡曲线如图所示,下列说法不 正确的是( )
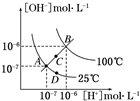

| A、图中四点KW间的关系:A=D<C<B |
| B、若从A点到C点,可采用温度不变在水中加少量CH3COONa固体 |
| C、若从A点到D点,可采用温度不变在水中加少量酸 |
| D、若处在B点所在的温度,将pH=2的硫酸与pH=10的NaOH的两种溶液等体积混合后,溶液显中性 |
控制适合的条件,将反应2Fe3++2I-=2Fe2++I2设计成如图所示的原电池.下列判断不正确的是( )

| A、反应开始时,乙中石墨电极上发生氧化反应 |
| B、反应开始时,甲中石墨电极上Fe3+被还原 |
| C、电流计读数为零时,反应达到化学平衡状态 |
| D、电流计读数为零后,在甲中溶入FeCl2固体 |
 丙:分子式C9H8O,(部分性质,能使Br2/CCl4褪色 )由甲出发合成丙的路线之一如下:
丙:分子式C9H8O,(部分性质,能使Br2/CCl4褪色 )由甲出发合成丙的路线之一如下:
 下列化合物:①HCl、②NaOH、③CH3COOH、④NH3?H2O、⑤CH3COONa、⑥NH4Cl
下列化合物:①HCl、②NaOH、③CH3COOH、④NH3?H2O、⑤CH3COONa、⑥NH4Cl