题目内容
下列叙述错误的是( )
| A、在加热搅拌条件下加入MgO,可除去MgCl2溶液中的Fe3+ |
| B、pH=4.5的番茄汁中c(H+ )是pH=6.5的牛奶中c(H+)的100倍 |
| C、常温下,CH3COONa和CH3COOH的混合溶液中(pH=7):C(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
| D、常温下,Cd(OH)2和Co(OH)2的混合悬浊液中,c(Cd2+)是c(Co2+)的3.5倍,已知:KSP(Cd(OH)2)=7.2×10-15,Ksp(Co(OH)2)=1.8×10-15 |
考点:离子浓度大小的比较,盐类水解的应用
专题:
分析:A.Fe3+易水解生成氢氧化铁沉淀,可加入MgO调节溶液pH的方法促进Fe3+的水解,从而除去铁离子;
B.根据c(H+ )=10-pHmol/L计算,溶液的pH相差2个单位,氢离子浓度相差100倍;
C.常温下溶液的pH=7,则c(H+)=c(OH-),根据电荷守恒可得:c(Na+)=c(CH3COO-);
D.同一溶液中,氢氧根离子浓度相等,则c(Cd2+)与c(Co2+)之比应该等于对应的溶度积之比.
B.根据c(H+ )=10-pHmol/L计算,溶液的pH相差2个单位,氢离子浓度相差100倍;
C.常温下溶液的pH=7,则c(H+)=c(OH-),根据电荷守恒可得:c(Na+)=c(CH3COO-);
D.同一溶液中,氢氧根离子浓度相等,则c(Cd2+)与c(Co2+)之比应该等于对应的溶度积之比.
解答:
解:A.加入的MgO与氢离子反应,可起到调节溶液pH的作用,促进铁离子的水解生成氢氧化铁沉淀而除去,且不引入新的杂质,故A正确;
B.pH=4.5的番茄汁中c(H+ )=10-4.5mol/L,是pH=6.5的牛奶中c(H+)=10-6.5mol/L,则前者氢离子浓度是后者的100倍,故B正确;
C.常温下,CH3COONa和CH3COOH的混合溶液的pH=7,混合液为中性,则溶液中满足:c(H+)=c(OH-),根据电荷守恒可得:c(Na+)=c(CH3COO-),由于加入的醋酸浓度较小,则溶液中离子浓度大小为:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-),故C正确;
D.常温下,Cd(OH)2和Co(OH)2的混合悬浊液中,氢氧根离子浓度相等,则c(Cd2+):c(Co2+)=Ksp(Cd(OH)2):Ksp(Co(OH)2)=7.2×10-15:1.8×10-15=4,故D错误;
故选D.
B.pH=4.5的番茄汁中c(H+ )=10-4.5mol/L,是pH=6.5的牛奶中c(H+)=10-6.5mol/L,则前者氢离子浓度是后者的100倍,故B正确;
C.常温下,CH3COONa和CH3COOH的混合溶液的pH=7,混合液为中性,则溶液中满足:c(H+)=c(OH-),根据电荷守恒可得:c(Na+)=c(CH3COO-),由于加入的醋酸浓度较小,则溶液中离子浓度大小为:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-),故C正确;
D.常温下,Cd(OH)2和Co(OH)2的混合悬浊液中,氢氧根离子浓度相等,则c(Cd2+):c(Co2+)=Ksp(Cd(OH)2):Ksp(Co(OH)2)=7.2×10-15:1.8×10-15=4,故D错误;
故选D.
点评:本题考查了离子浓度大小比较,题目难度较大,试题涉及盐的水解原理、难溶物溶度积的计算、离子浓度大小比较、溶液pH的计算等知识,注意把握电荷守恒、物料守恒、质子守恒的含义及应用方法.

练习册系列答案
相关题目
水的电离平衡曲线如图所示,下列说法不 正确的是( )
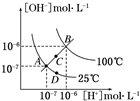

| A、图中四点KW间的关系:A=D<C<B |
| B、若从A点到C点,可采用温度不变在水中加少量CH3COONa固体 |
| C、若从A点到D点,可采用温度不变在水中加少量酸 |
| D、若处在B点所在的温度,将pH=2的硫酸与pH=10的NaOH的两种溶液等体积混合后,溶液显中性 |
下列化学方程式不正确的是( )
A、乙醇与浓氢溴酸反应:CH3CH2OH+HBr
| |||
B、溴乙烷与氢氧化钠溶液共热:CH3CH2HBr+NaOH
| |||
C、苯酚钠中通入二氧化碳2 +CO2+H2O→ +CO2+H2O→ +Na2CO3 +Na2CO3 | |||
D、蔗糖在稀硫酸作用下水解:C12H22O11(蔗糖)+H2O
|
控制适合的条件,将反应2Fe3++2I-=2Fe2++I2设计成如图所示的原电池.下列判断不正确的是( )

| A、反应开始时,乙中石墨电极上发生氧化反应 |
| B、反应开始时,甲中石墨电极上Fe3+被还原 |
| C、电流计读数为零时,反应达到化学平衡状态 |
| D、电流计读数为零后,在甲中溶入FeCl2固体 |
 的正确命名是( )
的正确命名是( )| A、2,2-二乙基丁烷 |
| B、3-甲基-2-乙基戊烷 |
| C、2-乙基-3甲基-戊烷 |
| D、3,4-二甲基己烷 |
 丙:分子式C9H8O,(部分性质,能使Br2/CCl4褪色 )由甲出发合成丙的路线之一如下:
丙:分子式C9H8O,(部分性质,能使Br2/CCl4褪色 )由甲出发合成丙的路线之一如下:
