题目内容
1.下列离子方程式不正确的是( )| A. | 在一定量的Ba(OH)2溶液中通入过量SO2气体SO2+OH-═HS${{O}_{3}}^{-}$ | |
| B. | 4 mol•L-1的NaAlO2溶液和7 mol•L-1的盐酸等体积混合4 Al${O}_{2}^{-}$+7H++H2O═3Al(OH)3↓+Al3+ | |
| C. | 在碳酸氢钠溶液中加入等物质的量的氢氧化钙溶液Ca2++HC${O}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| D. | 用惰性电极电解氯化铝溶液2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- |
分析 A.二氧化硫过量反应生成亚硫酸钡;
B.偏铝酸钠与盐酸反应先生成氢氧化铝,盐酸过量再与氢氧化铝反应生成氯化铝;
C.在碳酸氢钠溶液中加入等物质的量的氢氧化钙溶液反应生成碳酸钙、氢氧化钠和水;
D.D中电解产生OH-会与Al3+发生反应生成Al(OH)3.
解答 解:A.在一定量的Ba(OH)2溶液中通入过量SO2气体离子方程式:SO2+OH-═HSO3-,故A错误;
B.4 mol•L-1的NaAlO2溶液和7 mol•L-1的盐酸等体积混合,离子方程式:4 AlO2-+7H++H2O═3Al(OH)3↓+Al3+,故B正确;
C.在碳酸氢钠溶液中加入等物质的量的氢氧化钙溶液,离子方程式:Ca2++HCO3-+OH-═CaCO3↓+H2O,故C正确;
D.用惰性电极电解氯化铝溶液,离子方程式:2Al3++6Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$3Cl2↑+3H2↑+2Al(OH)3↓,故D错误;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子方程式书写遵循客观事实、遵循原子个数、电荷守恒,题目难度中等.

练习册系列答案
相关题目
11.下列离子方程式中,正确的是( )
| A. | KOH溶液和 KHSO4反应H++OH-=H2O | |
| B. | 铜和三氯化铁溶液反应Cu+Fe3+═Fe2++Cu2+ | |
| C. | 金属铝投入NaOH溶液中2Al+2OH-+H2O═2AlO2-+2H2↑ | |
| D. | 氧化亚铁和稀硝酸反应FeO+2H+═Fe2++H2O |
9.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 7.8 g Na2O2中含有的阴离子数目为0.2NA | |
| B. | 3.2 g O2和O3的混合气中含有的氧原子数目为0.2NA | |
| C. | 1 L 0.1 mol/L的Al2(SO4)3溶液中,Al3+的数目为0.2NA | |
| D. | 过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为0.2NA |
6.一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )
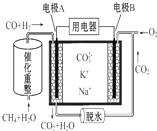

| A. | CH4+H2O$\frac{\underline{\;催化剂\;}}{△}$3 H2+CO,1 mol CH4参加反应转移12 mol电子 | |
| B. | 电极A为正极 | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | O2在B电极上被还原 |
13.下列实验操作与实验目的相符的是( )
| 序号 | 实验操作 | 实验目的 |
| A | 测定HF、HCl熔点、沸点 | 比较F和Cl的非金属性强弱 |
| B | MgSO4、Al2(SO4)3溶液中分别滴加足量氨水 | 比较镁、铝的金属性强弱 |
| C | 测定等浓度的H2CO3、H2SO3两溶液的pH | 比较碳、硫的非金属性强弱 |
| D | 向氯化铵、氯化铝混合溶液中滴加氢氧化钠溶液至过量 | 比较氨水和氢氧化铝的碱性强弱 |
| A. | A | B. | B | C. | C | D. | D |
10.香豆素是一种天然香料,也可通过下列反应制备:

下列有关说法中正确的是( )

下列有关说法中正确的是( )
| A. | 该反应属于加成反应 | |
| B. | 水杨醛能被酸性高锰酸钾溶液氧化为水杨酸 | |
| C. | 可用新制的Cu(OH)2悬浊液区别水扬醛和香豆素 | |
| D. | 水杨醛、乙酸肝和香豆素都能发生水解反应 |
19.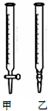 用0.1032mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,
用0.1032mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,
(1)某同学按下列步骤进行实验:①取一锥形瓶,用待测NaOH溶液润洗两次; ②在锥形瓶中加入
25,.00 mL待测NaOH溶液;③加入几滴石蕊试剂做指示剂;④取一支酸式滴定管,洗涤干净; ⑤直接往酸式滴定管中注入标准酸溶液,进行滴定; ⑥两眼注视着滴定管内盐酸溶液液面下降,直至滴定终点.
其中所述操作有错误的序号为①③⑤⑥
(2)取用25.00 mL待测NaOH溶液应用以下乙(选填:“甲”、“乙”)装置,若取用NaOH溶液开始平视读数、结束时俯视读数,会导致所测氢氧化钠溶液浓度偏大(填“偏大““偏小“或“不变“)
(3)若滴定开始前滴定管尖嘴中有一气泡,滴定结束后气泡消失,
则会导致所测氢氧化钠溶液浓度偏大(填“偏大““偏小“或“不变“)
(4)若平行实验三次,记录的数据如下表
试计算待测NaOH溶液的物质的量浓度(列出计算过程).
 用0.1032mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,
用0.1032mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,(1)某同学按下列步骤进行实验:①取一锥形瓶,用待测NaOH溶液润洗两次; ②在锥形瓶中加入
25,.00 mL待测NaOH溶液;③加入几滴石蕊试剂做指示剂;④取一支酸式滴定管,洗涤干净; ⑤直接往酸式滴定管中注入标准酸溶液,进行滴定; ⑥两眼注视着滴定管内盐酸溶液液面下降,直至滴定终点.
其中所述操作有错误的序号为①③⑤⑥
(2)取用25.00 mL待测NaOH溶液应用以下乙(选填:“甲”、“乙”)装置,若取用NaOH溶液开始平视读数、结束时俯视读数,会导致所测氢氧化钠溶液浓度偏大(填“偏大““偏小“或“不变“)
(3)若滴定开始前滴定管尖嘴中有一气泡,滴定结束后气泡消失,
则会导致所测氢氧化钠溶液浓度偏大(填“偏大““偏小“或“不变“)
(4)若平行实验三次,记录的数据如下表
| 滴定次数 | 待测溶液的体积(/mL) | 标准HCl溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.04 |
| 2 | 25.00 | 2.00 | 22.98 |
| 3 | 25.00 | 0.20 | 20.18 |
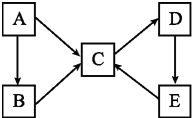 A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:
A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系: