题目内容
6.一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )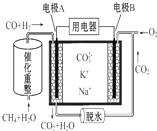
| A. | CH4+H2O$\frac{\underline{\;催化剂\;}}{△}$3 H2+CO,1 mol CH4参加反应转移12 mol电子 | |
| B. | 电极A为正极 | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | O2在B电极上被还原 |
分析 A.根据C元素的化合价变化分析;
B.通氧气的一极为正极;
C.原电池中阴离子向负极移动;
D.氧气得电子发生还原反应.
解答 解:A.1molCH4→CO,化合价由-4价→+2,上升6价,则1molCH4参加反应共转移6mol电子,故A错误;
B.通氧气的一极为正极,则B为正极,A为负极,故B错误;
C.原电池中阴离子向负极移动,A为负极,所以CO32-向电极A移动,故C错误;
D.B电极上氧气得电子发生还原反应,故D正确.
故选D.
点评 本题考查了化学电源新型电池,明确原电池中物质得失电子、电子流向、离子流向即可解答,题目难度不大.

练习册系列答案
相关题目
16.对下列装置图的叙述正确的是( )
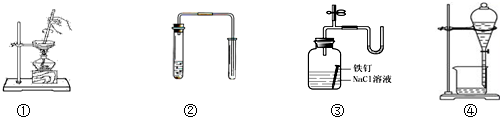

| A. | 装置①可用于加热蒸干氯化铵溶液得到氯化铵晶体 | |
| B. | 装置②可用于铜和稀硝酸制取并收集少量NO | |
| C. | 装置③可用于证明铁生锈氧气参与反应 | |
| D. | 苯萃取碘水中的碘后,从装置④下口放出的是碘的苯溶液 |
17.在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是( )
| A. | 范德华力、范德华力、离子键 | B. | 范德华力、共价键、共价键 | ||
| C. | 范德华力、范德华力、共价键 | D. | 共价键、共价键、共价键 |
14.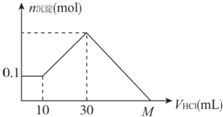 某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,将其一定量溶于水,有沉淀产生,在所得悬浊液中逐滴加入5 mol/L的盐酸,图表示盐酸加入量与沉淀量的变化关系,图中M点表示已加入的盐酸体积,则M点的体积是( )
某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,将其一定量溶于水,有沉淀产生,在所得悬浊液中逐滴加入5 mol/L的盐酸,图表示盐酸加入量与沉淀量的变化关系,图中M点表示已加入的盐酸体积,则M点的体积是( )
 某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,将其一定量溶于水,有沉淀产生,在所得悬浊液中逐滴加入5 mol/L的盐酸,图表示盐酸加入量与沉淀量的变化关系,图中M点表示已加入的盐酸体积,则M点的体积是( )
某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,将其一定量溶于水,有沉淀产生,在所得悬浊液中逐滴加入5 mol/L的盐酸,图表示盐酸加入量与沉淀量的变化关系,图中M点表示已加入的盐酸体积,则M点的体积是( )| A. | 70 mL | B. | 90 mL | C. | 100 mL | D. | 130 mL |
1.下列离子方程式不正确的是( )
| A. | 在一定量的Ba(OH)2溶液中通入过量SO2气体SO2+OH-═HS${{O}_{3}}^{-}$ | |
| B. | 4 mol•L-1的NaAlO2溶液和7 mol•L-1的盐酸等体积混合4 Al${O}_{2}^{-}$+7H++H2O═3Al(OH)3↓+Al3+ | |
| C. | 在碳酸氢钠溶液中加入等物质的量的氢氧化钙溶液Ca2++HC${O}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| D. | 用惰性电极电解氯化铝溶液2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- |
18.下列操作正确且能达到实验目的是( )
| A. |  验证化学能转化为电能 | B. |  制备无水氯化镁 | ||
| C. |  制备Fe(OH)2 | D. |  配制一定物质的量浓度的溶液 |
4.某学生测定CuSO4•xH2O晶体的x值,数据如下(已知x的理论值为5):
导致上述结果可能的原因是( )
| 坩埚的质量 | 坩埚的质量+晶体质量 | 失水后坩埚的质量+固体质量 |
| 11.70g | 14.2g | 13.2g |
| A. | 晶体中含有不分解的杂质 | B. | 没有放在干燥器中冷却 | ||
| C. | 实验前,晶体表面吸附水 | D. | 没有进行恒重操作 |
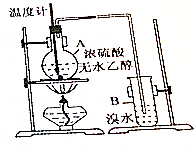 已知乙醇与浓硫酸加热到170℃时可生成乙烯:
已知乙醇与浓硫酸加热到170℃时可生成乙烯: