题目内容
9.用NA表示阿伏加德罗常数的值.下列说法正确的是( )| A. | 7.8 g Na2O2中含有的阴离子数目为0.2NA | |
| B. | 3.2 g O2和O3的混合气中含有的氧原子数目为0.2NA | |
| C. | 1 L 0.1 mol/L的Al2(SO4)3溶液中,Al3+的数目为0.2NA | |
| D. | 过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为0.2NA |
分析 A、求出过氧化钠的物质的量,然后根据过氧化钠中含2个钠离子和1个过氧根来分析;
B、氧气和臭氧均由氧原子构成;
C、铝离子是弱碱阳离子,在溶液中会水解;
D、求出氧气的物质的量,然后根据由过氧化氢来制取氧气,氧元素的价态由-1价变为0价.
解答 解:A、7.8g过氧化钠的物质的量为0.1mol,而过氧化钠中含2个钠离子和1个过氧根,故0.1mol过氧化钠中含0.1mol阴离子即0.1NA个,故A错误;
B、氧气和臭氧均由氧原子构成,故3.2g混合物中含有的氧原子的物质的量为n=$\frac{3.2g}{16g/mol}$=0.2mol,故含0.2NA个,故B正确;
C、铝离子是弱碱阳离子,在溶液中会水解,故溶液中铝离子的个数小于0.2NA个,故C错误;
D、标况下1.12L氧气的物质的量为0.05mol,而由过氧化氢来制取氧气,氧元素的价态由-1价变为0价,故当生成0.05mol氧气时转移0.1mol电子即0.1NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案
相关题目
19.下列有关SO2说法中不正确的是( )
| A. | SO2是污染大气的有害气体之一 | |
| B. | SO2在大气中与水反应生成硫酸,产生酸雨 | |
| C. | SO2可使澄清石灰水变浑浊 | |
| D. | SO2能使品红溶液褪色,加热溶液颜色恢复 |
17.在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是( )
| A. | 范德华力、范德华力、离子键 | B. | 范德华力、共价键、共价键 | ||
| C. | 范德华力、范德华力、共价键 | D. | 共价键、共价键、共价键 |
4. 臭氧是一种强氧化剂,常用于消毒、灭菌等.
臭氧是一种强氧化剂,常用于消毒、灭菌等.
(1)已知O3与KI溶液反应的生成物中有两种单质是I2和O2.
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示.
已知:O3的起始浓度为0.0216mol/L.
①pH增大能加速O3分解,表明对O3分解起催化作用的是OH-.
②在30°C、pH=4.0条件下,O3的分解速率为1.00×10-4 mol/(L•min).
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为bac.(填字母代号)
a.40°C、pH=3.0 b.10°C、pH=4.0 c.30°C、pH=7.0
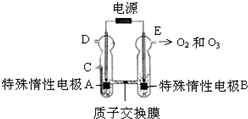
(3)O3可由臭氧发生器(原理如下图)电解稀硫酸制得.
①图中阴极为A(填“A”或“B”),其电极反应式为2H++2e-=H2↑.
②若C处通入O2,则A极的电极反应式为O2+4H++4e-=2H2O.
 臭氧是一种强氧化剂,常用于消毒、灭菌等.
臭氧是一种强氧化剂,常用于消毒、灭菌等.(1)已知O3与KI溶液反应的生成物中有两种单质是I2和O2.
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示.
已知:O3的起始浓度为0.0216mol/L.
pH t/min T/℃ | 3,.0 | 4,.0 | 5,.0 | 6,.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
②在30°C、pH=4.0条件下,O3的分解速率为1.00×10-4 mol/(L•min).
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为bac.(填字母代号)
a.40°C、pH=3.0 b.10°C、pH=4.0 c.30°C、pH=7.0
(3)O3可由臭氧发生器(原理如下图)电解稀硫酸制得.
①图中阴极为A(填“A”或“B”),其电极反应式为2H++2e-=H2↑.
②若C处通入O2,则A极的电极反应式为O2+4H++4e-=2H2O.
14.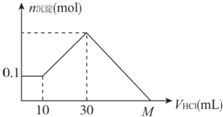 某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,将其一定量溶于水,有沉淀产生,在所得悬浊液中逐滴加入5 mol/L的盐酸,图表示盐酸加入量与沉淀量的变化关系,图中M点表示已加入的盐酸体积,则M点的体积是( )
某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,将其一定量溶于水,有沉淀产生,在所得悬浊液中逐滴加入5 mol/L的盐酸,图表示盐酸加入量与沉淀量的变化关系,图中M点表示已加入的盐酸体积,则M点的体积是( )
 某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,将其一定量溶于水,有沉淀产生,在所得悬浊液中逐滴加入5 mol/L的盐酸,图表示盐酸加入量与沉淀量的变化关系,图中M点表示已加入的盐酸体积,则M点的体积是( )
某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,将其一定量溶于水,有沉淀产生,在所得悬浊液中逐滴加入5 mol/L的盐酸,图表示盐酸加入量与沉淀量的变化关系,图中M点表示已加入的盐酸体积,则M点的体积是( )| A. | 70 mL | B. | 90 mL | C. | 100 mL | D. | 130 mL |
1.下列离子方程式不正确的是( )
| A. | 在一定量的Ba(OH)2溶液中通入过量SO2气体SO2+OH-═HS${{O}_{3}}^{-}$ | |
| B. | 4 mol•L-1的NaAlO2溶液和7 mol•L-1的盐酸等体积混合4 Al${O}_{2}^{-}$+7H++H2O═3Al(OH)3↓+Al3+ | |
| C. | 在碳酸氢钠溶液中加入等物质的量的氢氧化钙溶液Ca2++HC${O}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| D. | 用惰性电极电解氯化铝溶液2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- |
18.下列操作正确且能达到实验目的是( )
| A. |  验证化学能转化为电能 | B. |  制备无水氯化镁 | ||
| C. |  制备Fe(OH)2 | D. |  配制一定物质的量浓度的溶液 |
7.为研究沉淀的生成及其转化,某小组进行如下实验.关于该实验的分析不正确的是( )
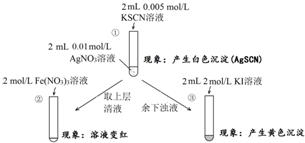

| A. | ①浊液中存在平衡:AgSCN(s)?Ag+(aq)+SCN-(aq) | |
| B. | ②中颜色变化说明上层清液中含有SCN- | |
| C. | ③中颜色变化说明有AgI生成 | |
| D. | 该实验可以证明AgI比AgSCN更难溶 |