题目内容
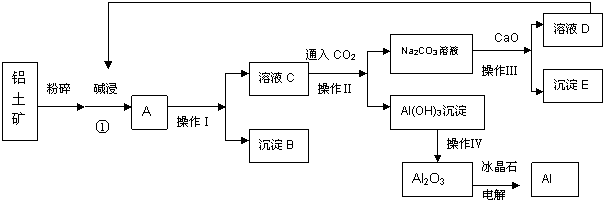
8.图是一种天然药物桥环分子合成的部分路线图(反应条件已经略去):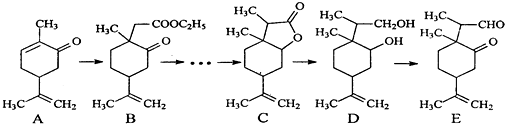
已知:
①LiBH4可将醛、酮、酯类还原成醇,但不能还原羧酸、羧酸盐、碳碳双键;LiBH4遇酸易分解.
②RCH2COOR′$→_{催化剂}^{CH_{3}I}$RCH(CH3)COOR′
RCOR′$→_{THF}^{LiBH_{4}}$RCH(OH)R′R-COOR$→_{THF}^{LiBH_{4}}$RCH2OH+R′OH
请回答下列问题:
(1)有机物B中含氧官能团的名称酯基、羰基.
(2)反应A→B中需要加入试剂X,其分子式为C4H8O2,X的结构简式为CH3COOC2H5.
(3)C用LiBH4还原得到D.C→D不直接用H2(镍作催化剂)还原的原因是碳碳双键也能与氢气发生加成反应,酯很难和H2发生还原反应.
(4)写出一种满足下列条件的A的同分异构体的结构简式为
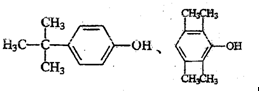 .
.①属于芳香族化合物;②能使FeCl3溶液显色;③分子中有4种不同化学环境的氢.
(5)写出E和银氨溶液反应的化学方程式
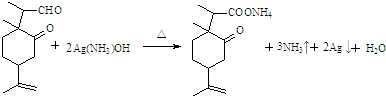 .
.(6)根据已有知识并结合相关信息,设计B→C的合成路线图(CH3I和无机试剂任选).
合成路线流程图例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
分析 (1)由B的结构结构简式,可知含氧官能团为酯基、羰基;
(2)反应A→B中需要加入试剂X,其分子式为C4H8O2,属于加成反应,则X为CH3COOC2H5;
(3)避免碳碳双键被H2加成或还原,酯很难和H2发生还原反应;
(4)①属于芳香族化合物,说明含有苯环;②能使FeCl3溶液显色,说明含有酚羟基;③核磁共振氢谱显示有4种不同化学环境的氢,结构应对称;
(5)E中醛基与银氨溶液发生氧化反应;
(6)比较B与C的结构简式,可知,B先在氢氧化钠的水溶液中发生水解反应,生成羧酸钠,然后将羰基用LiBH4还原为醇,然后酸化,将羧酸钠变为羧基,羧基与羟基在浓硫酸、加热条件下发生取代反应,生成酯基,最后再与CH3I发生增加C原子的反应得到C.
解答 解:(1)根据B的结构简式可知B中的含氧官能团为羰基和酯基,
故答案为:酯基、羰基;
(2)根据A与B的结构简式的异同,结合X的分子式可知,A转化为B属于加成反应,则X是CH3COOC2H5,
故答案为:CH3COOC2H5;
(3)C→D不直接用H2(镍作催化剂)还原的原因是:因为C中含有碳碳双键,碳碳双键也能与氢气发生加成反应,酯很难和H2发生还原反应,
故答案为:碳碳双键也能与氢气发生加成反应,酯很难和H2发生还原反应;
(4)A的同分异构体满足:①属于芳香族化合物,说明含有苯环;②能使FeCl3溶液显色,说明含有酚羟基;③核磁共振氢谱显示有4种不同化学环境的氢,A的分子式是C10H14O,则分子中存在对称结构,所以符合题意的A的同分异构体的结构简式是 ,
,
故答案为: ;
;
(5)E分子中的醛基可与银氨溶液反应,醛基被氧化为羧基,同时生成氨气、银单质、水,化学方程式是 ,
,
故答案为: ;
;
(6)比较B与C的结构简式,可知,B先在氢氧化钠的水溶液中发生水解反应,生成羧酸钠,然后将羰基用LiBH4还原为醇,然后酸化,将羧酸钠变为羧基,羧基与羟基在浓硫酸、加热条件下发生取代反应,生成酯基,最后再与CH3I发生增加C原子的反应得到C,合成流程图是: ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成、官能团的判断、同分异构体的书写、化学方程式的书写等,(6)中注意根据转化中隐含的信息进行设计,侧重于学生分析解决问题能力与知识迁移运用的考查.

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案| A. | 原子半径:A<B<C<D<E | |
| B. | 化合物AE与CE含有相同类型的化学键 | |
| C. | 金属性:D>C | |
| D. | D单质能够溶解于C的最高价氧化物对应的水化物 |
| A. | 常见单质的沸点:W>Y>Z | |
| B. | W的氢化物为共价化合物 | |
| C. | 原子半径:Y<Z<W | |
| D. | X、Y可以形成既有极性键也有非极性键的化合物 |
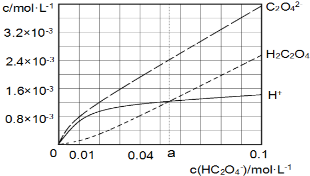 25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随c(HC2O4)的变化趋势如下图所示.下列说法正确的是( )
25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随c(HC2O4)的变化趋势如下图所示.下列说法正确的是( )| A. | 当c(HC2O4ˉ)=0.1mol•Lˉ1时,c(H+)>c(C2O42-)-c(H2C2O4) | |
| B. | 当c(HC2O4ˉ)>amol•Lˉ1时,c(H+)<c(H2C2O4),HC2O4ˉ的水解程度大于电离程度 | |
| C. | HC2O4ˉ?C2O42-+H+,Ka(HC2O4ˉ)=a | |
| D. | 将0.08mol•Lˉ1H2C2O4溶液与等浓度NaOH溶液等体积混合后(忽略体积变化),c(Na+)>c(HC2O4ˉ)>c(C2O42-)>c(H2C2O4)>c(H+)>c(OHˉ) |
(1)已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
| 气化反应式 | 1gK | ||
| 700K | 900K | 1200K | |
| C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
| C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
(2)业上合成甲醇的反应为:CO+2H2?CH3OH.已知:H2(g)、CO(g)、CH3OH(l)的燃烧热△H分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.则:CH3OH(l)不完全燃烧生成CO和液态H2O的热化学反应方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l);△H=-443.5kJ/mol.
(3)在一定温度、压强和催化条件下,工业上用H2CO和CO合成CH3OCH3:
3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-246.4KJ•mol-1
①在一定条件下的密闭容器中,该反应达到平衡,只改变一个条件能同时提高反应速率和CO的转化率的是cd(填字母序号).
a.降低温度 b.加入催化剂 c.缩小容器体积 d.增加H2的浓度 e.增加CO的浓度
②在一体积可变的密闭容器中充入3molH2、3molCO、1molCH3OCH3、1molCO2,在一定温度和压强下发生上述反应,经一定时间达到平衡,测得平衡时混合气体的密度是同温同压下起始的1.6倍.反应开始时正、逆反应速率的大小:v正>v逆(填“>”“<”或“=”),平衡时CO的物质的量分数为15%.
(4)一定条件下可用甲醇与CO反应生成醋酸消除CO污染,常温下,将amol•L-1的醋酸与bmol•L-1的Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=$\frac{2b}{a-2b}$×10-7 mol•L-1(用含a和b的代数式表示,体积变化忽略不计).
| A. | 熔点:Na>MgO>SiO2 | B. | 水溶性:SO2>H2S>HCl | ||
| C. | 热稳定性:HF>H2O>NH3 | D. | 沸点:HF>HCl>HBr |
| A. | (CH3)2CHCl | B. | CH3C(CH3)2I | C. | (CH3)3COOCCH2CH3 | D. | CH3C(CH3)2CH2Br |
 有如下化学反应:2A(g)+B(g)?2C(g),△H<0.
有如下化学反应:2A(g)+B(g)?2C(g),△H<0.