题目内容
4.氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如图1所示: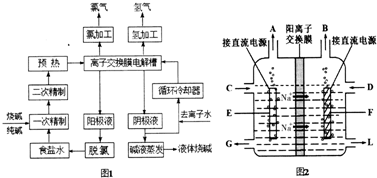
回答下列问题:
(1)该流程中可以循环使用的物质是氯化钠、氢氧化钠
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42-等杂质,所以在进入电解槽前需要进行两次精制.“一次精制”中生成沉淀的主要成分是CaCO3、Mg(OH)2(填化学式);若食盐水不经过“二次精制”、直接进入“离子交换膜电解槽”,这样产生的后果是用试剂处理后的盐水中还含有少量Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜.
(3)图2是“离子交换膜电解槽”示意图(阳极用惰性材料制成,阴极由碳钢网制成),B处产生的气体是H2,D处加入的物质为氢氧化钠稀溶液.
(4)电解槽中阳离子交换膜的作用和目的是阻止阴离子和气体通过,防止氢气和氯气混合,防止氯气与氢氧化钠反应.“阳极液”中通常含有少量氯酸钠、次氯酸钠及溶解氯,在“脱氯”前需先加入高纯盐酸除去氯酸钠,该反应的离子方程式为ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(5)已知在每个电解槽中,每小时通过1A的直电流,理论上可以产生1.492g烧碱.某工厂用300个电解槽串联生产8h,通过电解槽的电流强度为1.45×104A,制得32%的烧碱溶液(密度为1.342×103kg•m-3)113m3,则该电解生产过程中烧碱的产率为93.45%.
分析 (1)根据工艺流程图结合电解工艺的原料以及产物知识来判断;
(2)除去钙离子使用碳酸钠试剂,除去镁离子使用氢氧化钠试剂,根据处理后的盐水中还含有少量杂质离子对装置的影响角度来回答;
(3)电解池中,阳离子移向阴极,根据电极反应确定产物,根据电解池的工作原理来书写方程式,确定物质的种类;
(4)阳离子交换膜是为了阻止阴离子和气体通过,防止氢气和氯气混合,防止氯气与氢氧化钠反应;氯酸钠、次氯酸钠在酸性条件下发生归中反应生成氯气;
(5)计算生成NaOH的质量,根据理论耗电量和实际耗电量计算.
解答 解:(1)根据工艺流程图结中用到的原料以及产物,可以知道氯化钠、氢氧化钠是可以循环使用的,故答案为:氯化钠、氢氧化钠;
(2)除去钙离子使用碳酸钠试剂,Ca2++CO32-=CaCO3↓除去镁离子使用氢氧化钠试剂,Mg2++2OH-=Mg(OH)2↓,处理后的盐水中还含有少量杂质离子Mg2+、Ca2+,碱性条件下会生成沉淀,对装置中的交换膜产生影响,
故答案为:CaCO3、Mg(OH)2;用试剂处理后的盐水中还含有少量Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜;
(3)电解池中,阳离子钠离子移向阴极,所以B是电源的负极,A是正极,E是阳极,在阴极上产生的是氢气,电解饱和食盐水的原理方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,故B处产生的气体是氢气,D处加入的物质是氢氧化钠稀溶液,故答案为:H2;氢氧化钠稀溶液;
(4)阳离子交换膜是为了阻止阴离子和气体通过,防止氢气和氯气混合,防止氯气与氢氧化钠反应;氯酸钠、次氯酸钠在酸性条件下发生归中反应生成氯气,反应的离子方程式为ClO3-+5Cl-+6H+=3Cl2↑+3H2O,故答案为:阻止阴离子和气体通过,防止氢气和氯气混合,防止氯气与氢氧化钠反应;ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
(5)烧碱溶液质量为1.342×103kg/m3×113m3=1.516×105kg,
m(NaOH)=1.516×105kg×32%=4.85×104kg,
则理论上需要电流量为$\frac{4.85×1{0}^{7}g}{1.492g}$=3.252×107A,
则实际上耗电量为1.45×104A×8×300=3.48×107A,
则该电解生产过程中烧碱的产率=该电解槽的电解效率为$\frac{3.252}{3.48}$×100%=93.45%,
故答案为:93.45%.
点评 本题以氯碱工业为载体,考查学生生化学工艺流程题的解题方法知识,注意电解池的工作原理的灵活应用是关键,难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 13 | B. | 4个 | C. | 6个 | D. | 7个 |
| 实验现象 | 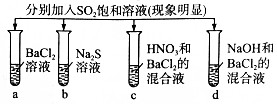 | |||
| A | 白色沉淀 | 臭鸡蛋气味气体 | 无色溶液 | 无色溶液 |
| B | 无色溶液 | 无色无味气体 | 白色沉淀 | 白色沉淀 |
| C | 无色溶液 | 浅黄色沉淀 | 白色沉淀 | 白色沉淀 |
| D | 白色沉淀 | 浅黄色沉淀 | 无色溶液 | 无色溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | NH4+和CH4 | B. | H3O+和NH3 | C. | NO3-和CO32- | D. | CO2和H2O |
 催化还原CO2是解决温室效应及能源问题的重要手段之一,研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
催化还原CO2是解决温室效应及能源问题的重要手段之一,研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-8 Ⅰ
CO2(g)+H2(g)?CO(g)+H2O(g)△H2 Ⅱ
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
已知:①CO和H2的标准燃烧热分别为-283.0kJ•mol-1和-285.8kJ•mol-1.
②H2O(1)═H2O(g)△H3=44.0kJ•mol-1
请回答(不考虑温度对△H的影响):
(1)反应I的平衡常数表达式K=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$;反应Ⅱ的△H2=+41.2kJ•mol-1.
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有CD.
A.使用催化剂Cat.1
B、使用催化剂Cat.2
C、降低反应温度
D、投料比不变,增加反应物的浓度
E、增大 CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是表中数据表明此时未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而再该时刻下对甲醇选择性有影响.
(4)在如图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图.
(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在阴极,该电极反应式是CO2+6H++6e-=CH3OH+H2O.
| A. | HClO4 H2SO4 H3PO4 H4SiO4 | B. | H2SO4 H2SO3 HNO3 HNO2 | ||
| C. | HClO4 HClO3 HClO2 HClO | D. | HClO4 H2SO4 H2SO3 H2CO3 |

 +H-OH→2
+H-OH→2
 .
. 外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式
外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式 ,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.写出其中一种的结构简式
,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.写出其中一种的结构简式 或
或 或
或 .
.