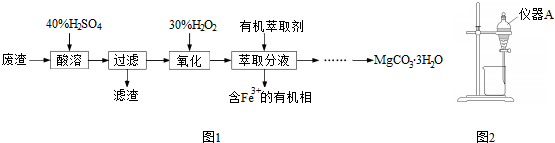
题目内容
1.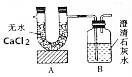 已知某燃料含有碳、氢、氧三种元素.为了测定该燃料的结构,现将1.04g燃料放人足量的氧气中充分燃烧,经测定消耗氧气1.568L(已转换为标准状况),并使产生的气体全部通人如图所示的装置,得到如表所示的实验数据(假设产生的气体被完全吸收,且没有空气进人该装置).
已知某燃料含有碳、氢、氧三种元素.为了测定该燃料的结构,现将1.04g燃料放人足量的氧气中充分燃烧,经测定消耗氧气1.568L(已转换为标准状况),并使产生的气体全部通人如图所示的装置,得到如表所示的实验数据(假设产生的气体被完全吸收,且没有空气进人该装置). | 实验前 | 实验后 | |
| A装置的质量 | 101.1g | 102.18g |
| B装置的质量 | 312.0g | 314.2g |
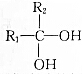 →
→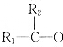 +H2O
+H2O根据实验数据回答下列问题.
(1)该燃料的分子式为C5H12O2.
(2)1mol该燃料与金属钠反应生成1molH2,则该燃料的分子结构种含有的官能团名称为羟基,若分子结构中有3个甲基,则燃料的结构简式为CH3CH(OH)COH(CH3)2.
(3)该燃料的一种同系物只有2个碳原子,写出该同系物与足量醋酸反应的化学方程式:CH2OHCH2OH+2CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O.
分析 A装置用于吸收水,由表中数据可知m(H2O)=102.18g-101.1g=1.08g,n(H2O)=$\frac{1.08g}{18g/mol}$=0.06mol,m(H)=0.06mol×2×1g/mol=0.12g,B装置用于吸收CO2,且m(CO2)=314.2g-312.0g=2.2g,n(CO2)=$\frac{2.2g}{44g/mol}$=0.05mol,m(C)=0.05mol×12g/mol=0.6g,则1.04g有机物含有m(O)=1.04g-0.12g-0.6g=0.32g,n(O)=$\frac{0.32g}{16g/mol}$=0.02mol,则有机物中N(C):N(H):N(O)=0.05:0.12:0.02=5:12:2,分子式应为C5H12O2,1mol该燃料与金属钠反应生成1molH2,说明应含有2个-OH,该燃料的一种同系物只有2个碳原子,应为CH2OHCH2OH,以此解答该题.
解答 解:(1)A装置用于吸收水,由表中数据可知m(H2O)=102.18g-101.1g=1.08g,n(H2O)=$\frac{1.08g}{18g/mol}$=0.06mol,m(H)=0.06mol×2×1g/mol=0.12g,B装置用于吸收CO2,且m(CO2)=314.2g-312.0g=2.2g,n(CO2)=$\frac{2.2g}{44g/mol}$=0.05mol,m(C)=0.05mol×12g/mol=0.6g,则1.04g有机物含有m(O)=1.04g-0.12g-0.6g=0.32g,n(O)=$\frac{0.32g}{16g/mol}$=0.02mol,则有机物中N(C):N(H):N(O)=0.05:0.12:0.02=5:12:2,分子式应为C5H12O2,
故答案为:C5H12O2;
(2)C5H12O2为饱和二元醇或醚,1mol该燃料与金属钠反应生成1molH2,说明应含有2个-OH,若分子结构中有3个甲基,则燃料的结构简式为CH3CH(OH)COH(CH3)2,故答案为:羟基;CH3CH(OH)COH(CH3)2;
(3)该燃料的一种同系物只有2个碳原子,应为CH2OHCH2OH,与足量乙酸发生酯化反应的方程式为CH2OHCH2OH+2CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O,
故答案为:CH2OHCH2OH+2CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O.
点评 本题考查有机物的推断,侧重于学生的分析、计算能力的考查,题目着重于考查有机物分子式的确定,题目难度较大,答题时注意有机物的分子式可从两个方面确定,一是根据质量守恒,如本题的解答方法,也可以根据氧元素守恒,根据消耗的氧和生成物含有的氧确定,结果会一样的.

| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
| A. | 最高价氧化物的水化物的碱性:A<C | |
| B. | B、D形成的化合物的溶于水形成B2D3溶液 | |
| C. | A、E形成的化合物只含离子键和极性键 | |
| D. | E的单质可以从D的氢化物中置换出D单质 |
| 实验现象 |  | |||
| A | 白色沉淀 | 臭鸡蛋气味气体 | 无色溶液 | 无色溶液 |
| B | 无色溶液 | 无色无味气体 | 白色沉淀 | 白色沉淀 |
| C | 无色溶液 | 浅黄色沉淀 | 白色沉淀 | 白色沉淀 |
| D | 白色沉淀 | 浅黄色沉淀 | 无色溶液 | 无色溶液 |
| A. | A | B. | B | C. | C | D. | D |
 催化还原CO2是解决温室效应及能源问题的重要手段之一,研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
催化还原CO2是解决温室效应及能源问题的重要手段之一,研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-8 Ⅰ
CO2(g)+H2(g)?CO(g)+H2O(g)△H2 Ⅱ
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
已知:①CO和H2的标准燃烧热分别为-283.0kJ•mol-1和-285.8kJ•mol-1.
②H2O(1)═H2O(g)△H3=44.0kJ•mol-1
请回答(不考虑温度对△H的影响):
(1)反应I的平衡常数表达式K=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$;反应Ⅱ的△H2=+41.2kJ•mol-1.
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有CD.
A.使用催化剂Cat.1
B、使用催化剂Cat.2
C、降低反应温度
D、投料比不变,增加反应物的浓度
E、增大 CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是表中数据表明此时未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而再该时刻下对甲醇选择性有影响.
(4)在如图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图.
(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在阴极,该电极反应式是CO2+6H++6e-=CH3OH+H2O.
| A. | K+、Ca2+、Cl-、CO${\;}_{3}^{2-}$ | B. | Na+、I-、Cl-、OH- | ||
| C. | NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$、K+、OH- | D. | Na+、Al3+、SO${\;}_{4}^{2-}$、HCO${\;}_{3}^{-}$ |
| A. | HClO4 H2SO4 H3PO4 H4SiO4 | B. | H2SO4 H2SO3 HNO3 HNO2 | ||
| C. | HClO4 HClO3 HClO2 HClO | D. | HClO4 H2SO4 H2SO3 H2CO3 |
| A. | C2H2和C6H6 | B. | C2H4和C3H8 | C. | C2H4和C3H6 | D. | C3H6和C3H8 |
①空气 ②CO2 ③Ar ④H2 ⑤N2.
| A. | ①和② | B. | ②和④ | C. | ③和④ | D. | ④和⑤ |