题目内容
5.类比推理是化学中常用的思维方法.下列推理正确的是( )| A. | CO2是直线型分子,推测CS2也是直线型分子 | |
| B. | SiH4的沸点高于CH4,推测H2Se的沸点高于H2S | |
| C. | Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3 | |
| D. | NaCl与浓H2SO4加热可制HCl,推测NaBr与浓H2SO4加热可制HBr |
分析 A.O和S同主族,二者形成的CO2和CS2都是直线形分子;
B.C和Si,Se和S都分别同族元素,形成的氢化物都为分子晶体,沸点取决于分子间作用力的大小;
C.I2的氧化性较弱,碘单质与铁反应生成FeI2;
D.浓硫酸能够将HBr氧化为Br2.
解答 解:A.O和S是同族元素,故形成的CO2和CS2都是直线形分子,该推理合理,故A正确;
B.C和Si,Se和S都分别为同族元素,所形成的氢化物都为分子晶体,沸点取决于分子间作用力的大小,分子间作用力大小可以用相对分子质量来比较,故B正确;
C.因I2的氧化性较弱,在碘单质与铁反应生成的是FeI2,故C错误;
D.浓硫酸氧化性很强,能够将HBr氧化为Br2,不能用该方法制取HBr,故D错误;
故选AB.
点评 本题考查较为综合,涉及分子构型、晶体性质、铁的化学性质、浓硫酸的性质等知识,题目难度中等,明确常见元素及其化合物性质为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.基态时,原子序数为13的主族元素原子核外电子所占据原子轨道数共有( )
| A. | 13 | B. | 4个 | C. | 6个 | D. | 7个 |
13.下列制质中,酸性由强到弱错误的是( )
| A. | HClO4 H2SO4 H3PO4 H4SiO4 | B. | H2SO4 H2SO3 HNO3 HNO2 | ||
| C. | HClO4 HClO3 HClO2 HClO | D. | HClO4 H2SO4 H2SO3 H2CO3 |
20.向新制氯水中加入少量下列物质,能增强溶液漂白能力的是( )
| A. | 碳酸钙粉末 | B. | 稀硫酸 | C. | 氯化钙溶液 | D. | 二氧化硫水溶液 |
4.下列各组烃的混合物,只要总质量一定,无论它们按什么比例混合,完全燃烧后生成的CO2和H2O都为恒量的是( )
| A. | C2H2和C6H6 | B. | C2H4和C3H8 | C. | C2H4和C3H6 | D. | C3H6和C3H8 |
9.苯与一卤代烷在催化剂作用下可生成苯的同系物: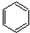 +CH3Cl$\stackrel{AlCl_{3}}{→}$
+CH3Cl$\stackrel{AlCl_{3}}{→}$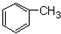 +HCl
+HCl
在催化剂存在下,由苯和下列各组物质合成乙苯最好应选用的是( )
 +CH3Cl$\stackrel{AlCl_{3}}{→}$
+CH3Cl$\stackrel{AlCl_{3}}{→}$ +HCl
+HCl在催化剂存在下,由苯和下列各组物质合成乙苯最好应选用的是( )
| A. | CH3CH3和Cl2 | B. | CH2=CH2和Cl2 | C. | CH2=CH2和HCl | D. | CH3CH3和HCl |