题目内容
1.下列离子方程式正确的是( )| A. | Na与水反应 Na+2H2O═Na++2OH-+H2↑ | |
| B. | 向AlCl3溶液中加入过量的NaOH溶液 Al3++3OH-═Al(OH)3↓ | |
| C. | 氢氧化钡溶液与硫酸溶液反应 Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | CO2通入过量澄清石灰水 CO2+Ca2++2OH-═CaCO3↓+H2O |
分析 A.2mol钠与水反应生成1mol氢气,该反应不满足电子守恒;
B.氢氧化钠过量,反应生成偏铝酸钠和水;
C.氢离子、氢氧根离子的系数错误;
D.氢氧化钙过量,反应生成碳酸钙沉淀和水.
解答 解:A.Na与水反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.向AlCl3溶液中加入过量的NaOH溶液,反应生成偏铝酸钠和水,正确的离子方程式为:Al(OH)3+0H-═AlO2 -+2H2O,故B错误;
C.氢氧化钡溶液与硫酸溶液反应生成硫酸钡沉淀和水,正确的离子方程式为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故C错误;
D.CO2通入过量澄清石灰水,反应生成碳酸钙沉淀和水,反应的离子方程式为:CO2+Ca2++2OH-═CaCO3↓+H2O,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
相关题目
12.自来水厂常用氯气给自来水消毒,某学生用自来水配制下列物质的溶液,不会产生明显药品变质的是( )
| A. | 亚硫酸钠 | B. | 硝酸银 | C. | 碳酸钠 | D. | 氯化铝 |
16.下列书写或说法正确的是( )
| A. | 聚丙烯的链节是-CH2-CH2-CH2- | |
| B. | 向苯酚溶液中滴加Na2CO3溶液:2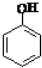 +CO${\;}_{3}^{2-}$→ +CO${\;}_{3}^{2-}$→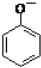 +CO2↑+H2O +CO2↑+H2O | |
| C. | 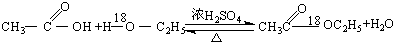 | |
| D. | 苯的同系物能使酸性高锰酸钾溶液褪色,说明烃基对苯环的性质产生了较大的影响 |
6.下列变化需要加入适当的氧化剂才能实现的是( )
| A. | CuO→Cu | B. | Fe→Fe2+ | C. | H2SO4→SO2 | D. | H2O2→O2 |
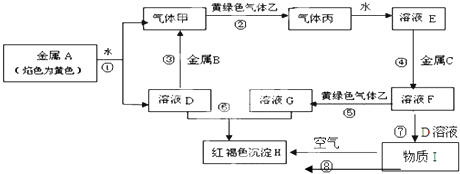

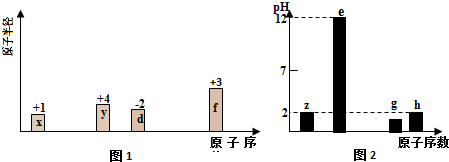
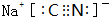 .
.