题目内容
3.合理利用燃料减小污染符合“绿色化学”理念,下列关于燃料的说法正确的是( )| A. | “可燃冰”是将水变为油的新型燃料 | |
| B. | 氢气是具有热值高、无污染等优点的燃料 | |
| C. | 天然气、海洋能、太阳能、生物质能、风能、氢能 都属于新能源 | |
| D. | 电能是一次能源 |
分析 A.可燃冰”外观像冰,其化学组成是CH4•nH2O;
B.氢气的热值高,且燃烧产物是水;
C.天然气等是化石燃料,不是新能源;
D.自然界中以现成形式提供的能源称为一次能源,需要依靠他能源的能量间接制取的能源称为二次能源.
解答 解:A.可燃冰”外观像冰,其化学组成是CH4•nH2O,水的化学式为H2O,根据元素守恒知,水不能变为油,故A错误;
B.氢能源具有来源广、热值高,且燃烧后生成水对环境无污染,故B正确;
C.海洋能、太阳能、生物质能、风能、氢能 都属于新能源,而天然气是化石能源,故C错误;
D.电能是通过物质燃烧放热转化成的,或是由风能、水能、核能等转化来的,属于二次能源,故D错误;
故选B.
点评 本题考查环境污染、能源分类及应用,题目难度不大,注意掌握常见能源类型,明确一次能源与二次能源、化石能源与新能源区别为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
3.以下实验设计能达到实验目的是( )
| 实验目的 | 实验设计 | |
| A. | 除去NaHCO3固体中的Na2CO3 | 将固体加热至恒重 |
| B. | 制备无水AlCl3 | 蒸发Al与稀盐酸反应后的溶液 |
| C. | 重结晶提纯苯甲酸 | 将粗品水溶、过滤、蒸发、结晶 |
| D. | 鉴别NaBr和KI溶液 | 分别加新制氯水后,用CCl4萃取 |
| A. | A | B. | B | C. | C | D. | D |
9.下列物质不属于烃的衍生物的是( )
| A. | CH3CH2Br | B. |  | C. |  | D. | CH3CH2OH |
6.通过以下反应可获得新型能源二甲醚(CH3OCH3 ).下列说法不正确的是
①C(s)+H2O(g)═CO(g)+H2 (g)△H1=a kJ•mol-1
②CO(g)+H2O(g)═CO2(g)+H2 (g)△H2=b kJ•mol-1
③CO2 (g)+3H2 (g)═CH3OH(g)+H2O(g)△H3=c kJ•mol-1
④2CH3OH(g)═CH3OCH3 (g)+H2O(g)△H4=d kJ•mol-1( )
①C(s)+H2O(g)═CO(g)+H2 (g)△H1=a kJ•mol-1
②CO(g)+H2O(g)═CO2(g)+H2 (g)△H2=b kJ•mol-1
③CO2 (g)+3H2 (g)═CH3OH(g)+H2O(g)△H3=c kJ•mol-1
④2CH3OH(g)═CH3OCH3 (g)+H2O(g)△H4=d kJ•mol-1( )
| A. | 反应①、②为反应③提供原料气 | |
| B. | 反应③也是 CO2资源化利用的方法之一 | |
| C. | 反应CH3OH(g)═$\frac{1}{2}$CH3OCH3 (g)+$\frac{1}{2}$H2O(l)的△H=$\frac{d}{2}$kJ•mol-1 | |
| D. | 反应 2CO(g)+4H2 (g)═CH3OCH3 (g)+H2O(g)的△H=( 2b+2c+d ) kJ•mol-1 |
8.一定体积的CH4在密闭容器中与一定量的氧气燃烧后得到的产物为CO、CO2和水蒸气,此混合气重4.96g,当其缓慢经过浓硫酸时,浓硫酸增重2.52g.原混合气体中CO2的质量为( )
| A. | 1.25g | B. | 1.32g | C. | 1.97g | D. | 2.44g |
15.下列反应中既属于氧化还原反应又属于放热热反应的是( )
| A. | 氢氧化钾与硫酸的反应 | B. | 锌与盐酸反应放出氢气 | ||
| C. | CO2通过炽热的焦炭发生的反应 | D. | Ba(OH)2•8H2O与NH4Cl反应 |
12.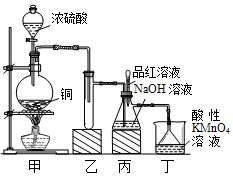 某化学兴趣小组设计实验,用浓硫酸与铜的反应制取SO2并进行相关实验探究,同时获得少量NaHSO3,实验装置如图所示:
某化学兴趣小组设计实验,用浓硫酸与铜的反应制取SO2并进行相关实验探究,同时获得少量NaHSO3,实验装置如图所示:
(1)装置甲中发生反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,装置乙的作用是防止丙中液体倒吸入装置甲中(或缓冲瓶的作用).
(2)装置丁的作用是吸收污染空气的SO2气体,其反应的离子方程为5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+.
(3)SO2气体有漂白性、还原性和氧化性.将SO2通入溴水中,SO2表现的是还原性,化学反应方程式为SO2+Br2+2H2O═H2SO4+2HCl.
(4)反应过程中,将丙中滴管里的品红溶液滴入锥形瓶,若现象为品红溶液褪色,则溶液中的NaOH完全转化为了NaHSO3.
(5)若丙中没有加入品红溶液,则不能准确判断氢氧化钠是否完全转化.现有可供选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2mol/L盐酸、2mol/L硝酸、1mol/L氯化钡溶液、l mol/L氢氧化钡溶液、品红溶液、蒸馏水.请设计实验探究吸收后产物中是否存在NaHSO3和Na2SO3,将实验操作、预期的实验现象和结论填在下表中.
 某化学兴趣小组设计实验,用浓硫酸与铜的反应制取SO2并进行相关实验探究,同时获得少量NaHSO3,实验装置如图所示:
某化学兴趣小组设计实验,用浓硫酸与铜的反应制取SO2并进行相关实验探究,同时获得少量NaHSO3,实验装置如图所示:(1)装置甲中发生反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,装置乙的作用是防止丙中液体倒吸入装置甲中(或缓冲瓶的作用).
(2)装置丁的作用是吸收污染空气的SO2气体,其反应的离子方程为5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+.
(3)SO2气体有漂白性、还原性和氧化性.将SO2通入溴水中,SO2表现的是还原性,化学反应方程式为SO2+Br2+2H2O═H2SO4+2HCl.
(4)反应过程中,将丙中滴管里的品红溶液滴入锥形瓶,若现象为品红溶液褪色,则溶液中的NaOH完全转化为了NaHSO3.
(5)若丙中没有加入品红溶液,则不能准确判断氢氧化钠是否完全转化.现有可供选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2mol/L盐酸、2mol/L硝酸、1mol/L氯化钡溶液、l mol/L氢氧化钡溶液、品红溶液、蒸馏水.请设计实验探究吸收后产物中是否存在NaHSO3和Na2SO3,将实验操作、预期的实验现象和结论填在下表中.
| 实验操作 | 预期现象与结论 |
| 步骤1:取少量待测液放入试管中,滴加过量lmol/L氯化钡溶液.静置一段时间后,得到滤液A和固体B. | |
| 步骤2:往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再滴加盐酸. | 若品红褪色(或有气泡),则说明含有Na2SO3. |
| 步骤3:用试管取少量A,向其中加入过量的氢氧化钡溶液或先加入品红再加入盐酸. | 若若生成白色沉淀或品红褪色,则说明有NaHSO3生成; 否则不存在NaHSO3. |

 .
.