题目内容
3.以下实验设计能达到实验目的是( )| 实验目的 | 实验设计 | |
| A. | 除去NaHCO3固体中的Na2CO3 | 将固体加热至恒重 |
| B. | 制备无水AlCl3 | 蒸发Al与稀盐酸反应后的溶液 |
| C. | 重结晶提纯苯甲酸 | 将粗品水溶、过滤、蒸发、结晶 |
| D. | 鉴别NaBr和KI溶液 | 分别加新制氯水后,用CCl4萃取 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.碳酸氢钠加热分解生成碳酸钠;
B.蒸发时促进氯化铝水解,生成的盐酸易挥发;
C.苯甲酸在水中的溶解度不大,且利用溶解度受温度影响的差异分离;
D.氯气与NaBr、NaI反应分别生成溴、碘,在四氯化碳中的颜色不同.
解答 解:A.碳酸氢钠加热分解生成碳酸钠,加热将原物质除去,不能除杂,故A错误;
B.蒸发时促进氯化铝水解,生成的盐酸易挥发,则应在HCl气流中蒸发结晶,故B错误;
C.苯甲酸在水中的溶解度不大,应趁热过滤后,选择重结晶法分离提纯,故C错误;
D.氯气与NaBr、NaI反应分别生成溴、碘,在四氯化碳中的颜色不同,则分别加新制氯水后,用CCl4萃取后观察颜色可鉴别,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离提纯、物质的鉴别为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,选项C为解答的难点,题目难度不大.

练习册系列答案
相关题目
14.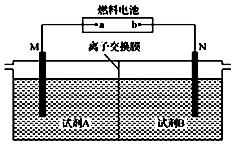 以二甲醚(CH3OCH3)酸性燃料电池为电源,电解饱和食盐水制备氯气和烧碱,设计装置如图所示.已知:a电扱的反应式为O2+4H++4e-═2H2O,下列说法不正确的是( )
以二甲醚(CH3OCH3)酸性燃料电池为电源,电解饱和食盐水制备氯气和烧碱,设计装置如图所示.已知:a电扱的反应式为O2+4H++4e-═2H2O,下列说法不正确的是( )
 以二甲醚(CH3OCH3)酸性燃料电池为电源,电解饱和食盐水制备氯气和烧碱,设计装置如图所示.已知:a电扱的反应式为O2+4H++4e-═2H2O,下列说法不正确的是( )
以二甲醚(CH3OCH3)酸性燃料电池为电源,电解饱和食盐水制备氯气和烧碱,设计装置如图所示.已知:a电扱的反应式为O2+4H++4e-═2H2O,下列说法不正确的是( )| A. | b电极的反应式为CH3OCH3+3H2O-12e-═2CO2↑+12H+ | |
| B. | 试剂A为饱和食盐水,试刑B为NaOH稀溶液 | |
| C. | 阳极生成1 mol气体时,有1mol离子通过离子交换膜 | |
| D. | 阴极生成1 mol气体时,理论上导线中流过2 mol e- |
14.用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4-H2C2O4混合溶液.下列叙述错误的是( )
| A. | 待加工铝质工件为阳极 | |
| B. | 可选用不锈钢网作为阴极 | |
| C. | 阴极的电极反应式为:Al3++3e-═Al | |
| D. | 硫酸根离子在电解过程中向阳极移动 |
11.化学与生活密切相关.下列说法错误的是( )
| A. | PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物 | |
| B. | 绿色化学要求从源头上消除或减少生产活动对环境的污染 | |
| C. | 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放 | |
| D. | 天然气和液化石油气是我国目前推广使用的清洁燃料 |
2.纯碱是重要的化工原料,在医药、冶金、化工、食品等领域被广泛使用.
(1)工业生产纯碱的第一步是除去饱和食盐水的中Mg2+、Ca2+离子,从成本角度考虑加入试剂的化学式为Ca(OH)2、Na2CO3.
某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如图1: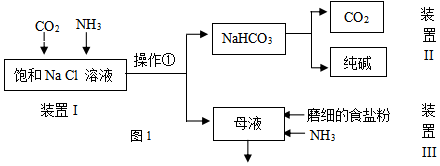
已知:几种盐的溶解度
(2)①写出装置I中反应的化学方程式NaCl+CO2+NH3+H2O=NaHCO3+NH4Cl.
②从平衡移动角度解释该反应发生的原因在溶液中存在下述两种平衡NH3+H2O?NH3•H2O?NH4++OH-,CO2+H2O?H2CO3?H++HCO3-,OH-与H+结合生成水,促进两平衡正向移动,使溶液中的NH4+和HCO3-浓度均增大,由于NaHCO3溶解度小,因此HCO3-与Na+结合生成NaHCO3,固体析出使得反应发生.
③操作①的名称是过滤.
(3)写出装置II中发生反应的化学方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
(4)请结合化学用语说明装置III中加入磨细的食盐粉及NH3的作用.在母液中含有大量的NH4+和Cl-,存在平衡NH4Cl(s)?NH4++Cl-,通入氨气增大NH4+的浓度,加入磨细的食盐粉,增大Cl-的浓度,使上述平衡逆向移动,促使氯化铵结晶析出
(5)该流程中可循环利用的物质是氯化钠和二氧化碳
(6)制出的纯碱中含有杂质NaCl,为测定其纯度,下列方案中不可行的是c.
a.向m克纯碱样品中加入足量CaCl2溶液,测生成CaCO3的质量
b.向m克纯碱样品中加入足量稀H2SO4,干燥后测生成气体的体积
c.向m克纯碱样品中加入足量AgNO3溶液,测生成沉淀的质量.
(1)工业生产纯碱的第一步是除去饱和食盐水的中Mg2+、Ca2+离子,从成本角度考虑加入试剂的化学式为Ca(OH)2、Na2CO3.
某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如图1:

已知:几种盐的溶解度
| NaCl | NH4HCO3 | NaHCO3 | NH4Cl | |
| 溶解度(20°C,100gH2O时) | 36.0 | 21.7 | 9.6 | 37.2 |
②从平衡移动角度解释该反应发生的原因在溶液中存在下述两种平衡NH3+H2O?NH3•H2O?NH4++OH-,CO2+H2O?H2CO3?H++HCO3-,OH-与H+结合生成水,促进两平衡正向移动,使溶液中的NH4+和HCO3-浓度均增大,由于NaHCO3溶解度小,因此HCO3-与Na+结合生成NaHCO3,固体析出使得反应发生.
③操作①的名称是过滤.
(3)写出装置II中发生反应的化学方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
(4)请结合化学用语说明装置III中加入磨细的食盐粉及NH3的作用.在母液中含有大量的NH4+和Cl-,存在平衡NH4Cl(s)?NH4++Cl-,通入氨气增大NH4+的浓度,加入磨细的食盐粉,增大Cl-的浓度,使上述平衡逆向移动,促使氯化铵结晶析出
(5)该流程中可循环利用的物质是氯化钠和二氧化碳
(6)制出的纯碱中含有杂质NaCl,为测定其纯度,下列方案中不可行的是c.
a.向m克纯碱样品中加入足量CaCl2溶液,测生成CaCO3的质量
b.向m克纯碱样品中加入足量稀H2SO4,干燥后测生成气体的体积
c.向m克纯碱样品中加入足量AgNO3溶液,测生成沉淀的质量.
6.H2O2分解速率受多种因素影响.实验测得 70℃时不同条件下H2O2浓度随时间的变化如图所示.下列说法正确的是( )
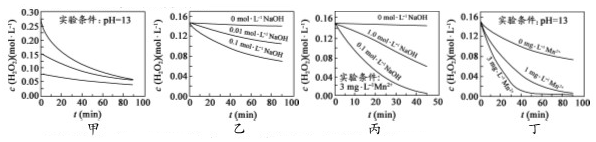

| A. | 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快 | |
| B. | 图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快 | |
| C. | 图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快 | |
| D. | 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大 |
3.合理利用燃料减小污染符合“绿色化学”理念,下列关于燃料的说法正确的是( )
| A. | “可燃冰”是将水变为油的新型燃料 | |
| B. | 氢气是具有热值高、无污染等优点的燃料 | |
| C. | 天然气、海洋能、太阳能、生物质能、风能、氢能 都属于新能源 | |
| D. | 电能是一次能源 |
 研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景.回答下列问题:
研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景.回答下列问题: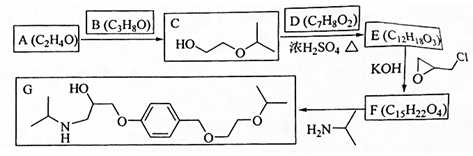
 .
.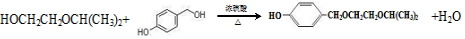 .
.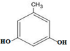 、
、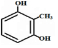 .
.