题目内容
12.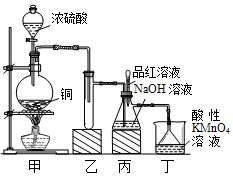 某化学兴趣小组设计实验,用浓硫酸与铜的反应制取SO2并进行相关实验探究,同时获得少量NaHSO3,实验装置如图所示:
某化学兴趣小组设计实验,用浓硫酸与铜的反应制取SO2并进行相关实验探究,同时获得少量NaHSO3,实验装置如图所示:(1)装置甲中发生反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,装置乙的作用是防止丙中液体倒吸入装置甲中(或缓冲瓶的作用).
(2)装置丁的作用是吸收污染空气的SO2气体,其反应的离子方程为5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+.
(3)SO2气体有漂白性、还原性和氧化性.将SO2通入溴水中,SO2表现的是还原性,化学反应方程式为SO2+Br2+2H2O═H2SO4+2HCl.
(4)反应过程中,将丙中滴管里的品红溶液滴入锥形瓶,若现象为品红溶液褪色,则溶液中的NaOH完全转化为了NaHSO3.
(5)若丙中没有加入品红溶液,则不能准确判断氢氧化钠是否完全转化.现有可供选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2mol/L盐酸、2mol/L硝酸、1mol/L氯化钡溶液、l mol/L氢氧化钡溶液、品红溶液、蒸馏水.请设计实验探究吸收后产物中是否存在NaHSO3和Na2SO3,将实验操作、预期的实验现象和结论填在下表中.
| 实验操作 | 预期现象与结论 |
| 步骤1:取少量待测液放入试管中,滴加过量lmol/L氯化钡溶液.静置一段时间后,得到滤液A和固体B. | |
| 步骤2:往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再滴加盐酸. | 若品红褪色(或有气泡),则说明含有Na2SO3. |
| 步骤3:用试管取少量A,向其中加入过量的氢氧化钡溶液或先加入品红再加入盐酸. | 若若生成白色沉淀或品红褪色,则说明有NaHSO3生成; 否则不存在NaHSO3. |
分析 (1)浓硫酸和铜反应生成硫酸铜、二氧化硫和水;二氧化硫极易溶于水和氢氧化钠溶液,应防止倒吸;
(2)二氧化硫具有还原性,可与酸性高锰酸钾发生氧化还原反应;
(3)二氧化硫可与氯气发生氧化还原反应;
(4)溶液中的NaOH完全转化为了NaHSO3,二氧化硫应过量,滴加品红褪色;
(5)实验探究吸收后产物中是否存在NaHSO3和Na2SO3,可取少量待测液放入试管中,滴加过量lmol/L氯化钡溶液,静置一段时间后,得到滤液A和固体B,往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再滴加盐酸,若品红褪色(或有气泡),则说明含有Na2SO3,然后用试管取少量A,向其中加入过量的氢氧化钡溶液或加入品红再加入盐酸,如生成白色沉淀或品红褪色,则说明有NaHSO3生成,否则不存在NaHSO3.
解答 解:(1)Cu与浓硫酸反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;浓硫酸和铜反应生成的二氧化硫极易溶于水和氢氧化钠溶液,应防止倒吸,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;防止丙中液体倒吸入装置甲中(或缓冲瓶的作用);
(2)二氧化硫具有还原性,可与酸性高锰酸钾发生氧化还原反应,反应的离子方程式为 5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+,
故答案为:5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+;
(3)二氧化硫可与氯气发生氧化还原反应生成硫酸和氯化氢,反应的化学方程式为:SO2+Cl2+2H2O═H2SO4+2HCl,
故答案为:还原;SO2+Cl2+2H2O═H2SO4+2HCl;
(4)溶液中的NaOH完全转化为了NaHSO3,二氧化硫应过量,滴加品红褪色,
故答案为:品红溶液褪色;
(5)实验探究吸收后产物中是否存在NaHSO3和Na2SO3,可取少量待测液放入试管中,滴加过量lmol/L氯化钡溶液,静置一段时间后,得到滤液A和固体B,往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再滴加盐酸,若品红褪色(或有气泡),则说明含有Na2SO3,然后用试管取少量A,向其中加入过量的氢氧化钡溶液或加入品红再加入盐酸,如生成白色沉淀或品红褪色,则说明有NaHSO3生成,否则不存在NaHSO3,
故答案为:
| 实验操作 | 预期现象与结论 |
| 滴加盐酸 | 含有Na2SO3 |
| 用试管取少量A,向其中加入过量的氢氧化钡溶液或先加入品红再加入盐酸. | 生成白色沉淀或品红褪色;说明有NaHSO3生成;不存在NaHSO3. |
点评 本题通过铜与浓硫酸的反应考查性质实验设计,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意把握物质的性质以及实验的设计方法,把握实验的严密性,难度中等.

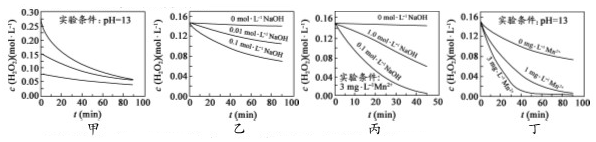
| A. | 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快 | |
| B. | 图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快 | |
| C. | 图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快 | |
| D. | 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大 |
| A. | “可燃冰”是将水变为油的新型燃料 | |
| B. | 氢气是具有热值高、无污染等优点的燃料 | |
| C. | 天然气、海洋能、太阳能、生物质能、风能、氢能 都属于新能源 | |
| D. | 电能是一次能源 |
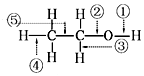
| A. | 当乙醇发生催化氧化时,被破坏的键是②③ | |
| B. | 当乙醇与Na反应时,被破坏的键是① | |
| C. | 当乙醇与乙酸反应时,被破坏的键是② | |
| D. | 当乙醇发生催化氧化时,被破坏的键是①④ |
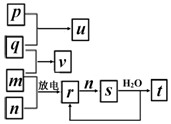 短周期主族元素X、Y、Z、W的原子序数依次增大.在如图所示的物质转化关系中,p、q、m、n分别是元素W、X、Y、Z的气体单质,p和s均为有色气体,v的水溶液呈碱性.常温下,0.1mol•L-1 t溶液与0.1mol•L-1 u溶液的pH 均为1.下列说法不正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.在如图所示的物质转化关系中,p、q、m、n分别是元素W、X、Y、Z的气体单质,p和s均为有色气体,v的水溶液呈碱性.常温下,0.1mol•L-1 t溶液与0.1mol•L-1 u溶液的pH 均为1.下列说法不正确的是( )| A. | Y、W的最高价氧化物对应的水化物均为强酸 | |
| B. | 元素的非金属性:Z>Y>X,原子半径:X<Z<Y | |
| C. | s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2 | |
| D. | v的电子式可表示为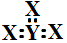 |
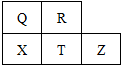 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断不正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断不正确的是( )| A. | 五种元素中Z的活动性最弱,T 的最高价氧化物对应水化合物酸性最强 | |
| B. | 氢化物的稳定性:R>Q>X;R>T>X | |
| C. | Q单质能从溶液中置换出X单质,R单质能从溶液中置换出Q单质 | |
| D. | X阴离子和T阴离子相比,半径:X阴离子的大;还原性:T阴离子的强 |
| A. | X与其它元素之间只能形成共价键 | |
| B. | Z元素的最高价氧化物是玻璃的主要成分,其常温下就能与强碱发生反应 | |
| C. | 非金属性Y强于Z | |
| D. | 三种元素中X的原子半径最小 |
 X、Y、Z是一种短周期元素,原子半径的大小为:r(Y)>r(X)>r(Z),三种元素的原子序数之和为16;X、Y、Z三种元素的常见单质在适当条件下可发生如图转化关系.其中R为10电子分子,是一种常见的无机溶剂.下列说法中不正确的是( )
X、Y、Z是一种短周期元素,原子半径的大小为:r(Y)>r(X)>r(Z),三种元素的原子序数之和为16;X、Y、Z三种元素的常见单质在适当条件下可发生如图转化关系.其中R为10电子分子,是一种常见的无机溶剂.下列说法中不正确的是( )| A. | X元素位于周期表中第16列 | |
| B. | X、Y、Z元素两两之间均能形成原子个数比为l:2的化合物 | |
| C. | X、Y、Z元素形成的化合物溶于水中,对水的电离平衡一定起抑制作用 | |
| D. | R和M的化学键类型和晶体类型都相同. |
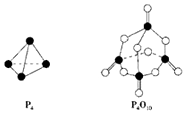 白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P═O c kJ•mol-1、O═O d kJ•mol-1.根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P═O c kJ•mol-1、O═O d kJ•mol-1.根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )| A. | (6a+5d-4c-12b) kJ•mol-1 | B. | (4c+12b-6a-5d) kJ•mol-1 | ||
| C. | (4c+12b-4a-5d) kJ•mol-1 | D. | (4c+5d-4a-12b) kJ•mol-1 |