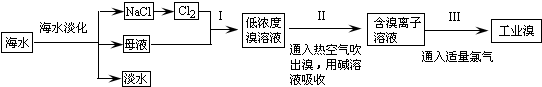
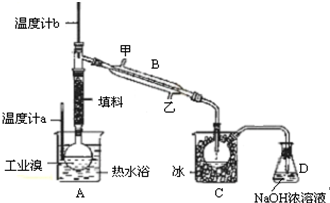
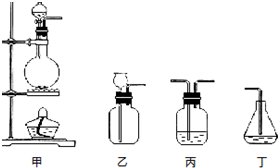
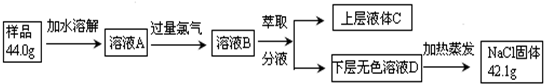
题目内容
8.F、CI和Br都是第七主族元素,关于这三种元素原子的说法正确的是( )| A. | 原子半径:F>CI>Br | B. | 最外层电子数都相同 | ||
| C. | 核外电子层数都相同 | D. | 最外层电子数都不相同 |
分析 F、Cl和Br都是VIIA族元素,最外层电子数相同,都为7,原子核电子层分别为2、3、4,同主族元素从上到下原子半径逐渐增大,据此进行解答.
解答 解:A.同主族元素从上到下原子半径逐渐增大,原子半径大小为:F<Cl<Br,故A错误;
B.F、Cl和Br都是VIIA族元素,最外层电子数都为7,最外层电子数都相同,故B正确;
C.F、Cl和Br原子核电子层分别为2、3、4,核外电子层数不相同,故C错误;
D.F、Cl和Br都是VIIA族元素,最外层电子数相同,都含有7个电子,故D错误;
故选B.
点评 本题考查同主族元素的结构和性质,题目难度不大,明确同主族元素的结构特点和性质的递变规律为解答关键,注意掌握元素周期律内容.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
18.下列性质不能用来比较金属性强弱的是( )
| A. | 同主族金属原子半径的大小 | |
| B. | 单质的熔沸点高低 | |
| C. | 与酸反应的剧烈程度 | |
| D. | 最高价氧化物对应水化物的碱性强弱 |
16.下列有关元素周期表的描述中不正确的是( )
| A. | 第七周期叫不完全周期 | B. | 族有两类:主族和副族 | ||
| C. | 有18个列16个族 | D. | 金属元素位于表的左下部 |
3.表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )


| A. | 常压下五种元素的单质中,Z单质的沸点最高 | |
| B. | Y、Z的阴离子电子层结构都与R原子的相同 | |
| C. | 最高价氧化物对应的水化物的酸性W强于X | |
| D. | Y元素非金属性比W元素的非金属性强 |
13.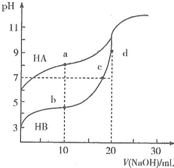 常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mo1•L-1的HA溶液和HB溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mo1•L-1的HA溶液和HB溶液,所得滴定曲线如图所示.下列说法正确的是( )
 常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mo1•L-1的HA溶液和HB溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mo1•L-1的HA溶液和HB溶液,所得滴定曲线如图所示.下列说法正确的是( )| A. | HA的酸性强于HB | B. | d点溶液中:c(Na+)>c(OH-)>c(B-)>c(H+) | ||
| C. | a和b点溶液中:c(B-)<c(A-) | D. | b点溶液中:c(B-)+2c(OH)-=c(HB)+2c(H+) |
18.在一定条件下X既能与Y又能与Z发生氧化还原反应,且都有单质生成的是( )
| 选项 | X | Y | Z |
| A | Al | NaOH(aq) | CuO(s) |
| B | Fe3O4 | HNO3(aq) | HI(aq) |
| C | Mg | NaOH(aq) | HCl(aq) |
| D | NaOH(aq) | AlCl3(aq) | HNO3(aq) |
| A. | A | B. | B | C. | C | D. | D |