题目内容
2.自来水常用氯气消毒,某实验室用自来水配制下列物质的溶液,不会产生明显药品变质问题的是( )| A. | FeCl2 | B. | Na2SO4 | C. | NaOH | D. | AlCl3 |
分析 氯水中含有H+、Cl2、HClO、ClO-、Cl-等微粒,表现酸性和强氧化性,从离子反应的角度进行分析.
解答 解:A.氯水中含有Cl2、HClO、ClO-等微粒,具有氧化性,能氧化亚铁离子,则产生明显的药品变质问题,故A错误;
B.氯水中含有的微粒不会与Na2SO4溶液中的微粒发生反应,则不会产生明显的药品变质问题,故B正确;
C.氯水中含有H+,H+能与氢氧化钠反应生成水和氯化钠,则产生明显的药品变质问题,故C错误;
D.氯水中含有的微粒不会与AlCl3溶液中的微粒发生反应,则不会产生明显的药品变质问题,故D正确;
故选:BD.
点评 本题考查溶液的配制,侧重于氯水的成分和性质的考查,为高频考点,明确氯水中的成分及离子之间的反应是解答本题的关键,难度不大.

练习册系列答案
相关题目
13.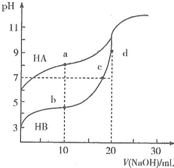 常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mo1•L-1的HA溶液和HB溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mo1•L-1的HA溶液和HB溶液,所得滴定曲线如图所示.下列说法正确的是( )
 常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mo1•L-1的HA溶液和HB溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mo1•L-1的HA溶液和HB溶液,所得滴定曲线如图所示.下列说法正确的是( )| A. | HA的酸性强于HB | B. | d点溶液中:c(Na+)>c(OH-)>c(B-)>c(H+) | ||
| C. | a和b点溶液中:c(B-)<c(A-) | D. | b点溶液中:c(B-)+2c(OH)-=c(HB)+2c(H+) |
10.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
请回答:
(1)从①组情况分析,HA是强酸还是弱酸弱酸(填“强酸”或“弱酸”);
(2)①组实验所得混合溶液中由水电离出的c(OH-)=10-5mol•L-1.
(3)②组情况表明,c大于0.2mol/L(选填“大于”、“小于”或“等于”).混合液中离子浓度c(A-)与c(Na+)的大小关系是等于.
(4)从③组实验结果分析,说明HA的电离程度大于NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
(1)从①组情况分析,HA是强酸还是弱酸弱酸(填“强酸”或“弱酸”);
(2)①组实验所得混合溶液中由水电离出的c(OH-)=10-5mol•L-1.
(3)②组情况表明,c大于0.2mol/L(选填“大于”、“小于”或“等于”).混合液中离子浓度c(A-)与c(Na+)的大小关系是等于.
(4)从③组实验结果分析,说明HA的电离程度大于NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
14.置于空气中的下列物质,因被氧化而呈现黄色的是( )
| A. | 浓硝酸 | B. | 氯化亚铁溶液 | C. | 工业盐酸 | D. | 溴化银 |
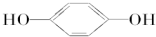 E;
E;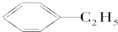 H;
H; 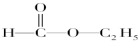 I;
I;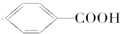 G;
G; 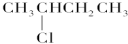 J.
J. 在2L的密闭容器中,高温下发生下列反应:
在2L的密闭容器中,高温下发生下列反应: