题目内容
4. CuSO4•5H2O是铜的重要化合物,有着广泛的应用.硫酸铜在高温下分解可得到SO2、SO3、O2和Cu2O.
CuSO4•5H2O是铜的重要化合物,有着广泛的应用.硫酸铜在高温下分解可得到SO2、SO3、O2和Cu2O.Ⅰ.甲组同学在实验室利用铜粉、稀硫酸和浓硝酸制备CuSO4•5H2O.
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象溶液呈蓝色,有红棕色气体生成.
(2)制得的CuSO4•5H2O中可能存在的杂质是Cu(NO3)2,除去这种杂质的实验操作名称为重结晶.
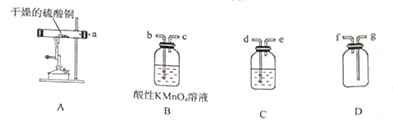
Ⅱ.乙组同学在坩埚中加热硫酸铜晶体使其失去结晶水,然后选用下列装置验证硫酸铜的分解产物.可供选择的试剂有盐酸、稀硝酸、Ba(OH)2溶液、BaCl2溶液.
(1)C中的试剂是BaCl2溶液;为实现检验气体产物的目的,仪器的导管连接顺序为adebcgf;
(2)不能将装置B中的试剂换成品红溶液,原因是因为SO2不能全部被品红溶液吸收,影响氧气的检验;
(3)证明有SO3存在的装置中,反应的总离子方程式为SO3+H2O+Ba2+=BaSO4↓+2H+;
证明有氧气生成的实验操作为:取下D的橡皮塞,将带火星的木条伸入D中;设计实验证明固体产物中含有Cu2O取少量固体产物于试管中,加入足量的稀盐酸,若得到蓝色溶液与红色固体,则固体产物中含有Cu2O.
(已知酸性条件下,Cu2O不稳定,会自动转化为Cu、Cu2+)
分析 I.(1)铜与浓硝酸反应生成二氧化氮和硝酸铜;
(2)根据反应物判断可能存在的杂质,溶解度不同的可溶性盐可用重结晶法分离;
II.(1)硫酸铜分解生成CuO、二氧化硫、三氧化硫和氧气,检验三氧化硫用BaCl2溶液,检验二氧化硫用酸性高锰酸钾溶液,并且用高锰酸钾溶液吸收二氧化硫;
(2)B装置中的溶液检验并吸收二氧化硫,品红溶液的浓度较小,不能完全吸收二氧化硫;
(3)三氧化硫与BaCl2反应生成白色沉淀,二氧化硫与BaCl2不反应;用带火星的木条检验氧气;Cu2O固体溶于盐酸会形成蓝色溶液,同时有固体剩余.
解答 解:I.(1)铜与浓硝酸反应为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,生成硫酸铜和二氧化氮气体,所以反应现象为:溶液呈蓝色,有红棕色气体生成;
故答案为:溶液呈蓝色,有红棕色气体生成;
(2)混有硝酸铜杂质,需利用溶解度的不同,用重结晶的方法进行分离,
故答案为:Cu(NO3)2、重结晶;
II.(1)硫酸铜分解生成CuO、二氧化硫、三氧化硫和氧气,检验三氧化硫用BaCl2溶液,所以C试剂瓶中盛放的溶液为BaCl2溶液;检验二氧化硫用酸性高锰酸钾溶液,并且用高锰酸钾溶液吸收二氧化硫;用D装置收集氧气,所以仪器的导管连接顺序为adebcgf;
故答案为:BaCl2溶液;adebcgf;
(2)B装置中的溶液检验并吸收二氧化硫,品红溶液的浓度较小,用品红溶液检验二氧化硫,但不能完全吸收二氧化硫,会用二氧化硫剩余,二氧化氯与氧气一起进入D中,会干扰氧气的检验;
故答案为:因为SO2不能全部被品红溶液吸收,影响氧气的检验;
(3)三氧化硫与BaCl2反应生成白色沉淀,二氧化硫与BaCl2不反应,SO3与BaCl2溶液反应生成BaSO4沉淀,其反应的离子方程式为:SO3+H2O+Ba2+=BaSO4↓+2H+;
D装置收集的气体为氧气,将带火星的木条伸入D中,若木条复燃,说明D中气体是氧气;Cu2O盐酸反应生成氯化铜和Cu,会形成蓝色溶液,同时有固体剩余,则检验方法为:取少量固体产物于试管中,加入足量的稀盐酸,若得到蓝色溶液与红色固体,则固体产物中含有Cu2O.
故答案为:SO3+H2O+Ba2+=BaSO4↓+2H+;将带火星的木条伸入D中;取少量固体产物于试管中,加入足量的稀盐酸,若得到蓝色溶液与红色固体,则固体产物中含有Cu2O.
点评 本题考查了铜及其化合物的性质、实验探究方案设计、物质的检验等,题目难度中等,侧重于考查学生的实验探究能力和对基础知识的综合应用能力,注意把握常见物质的检验方法.

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案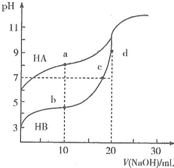 常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mo1•L-1的HA溶液和HB溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mo1•L-1的HA溶液和HB溶液,所得滴定曲线如图所示.下列说法正确的是( )| A. | HA的酸性强于HB | B. | d点溶液中:c(Na+)>c(OH-)>c(B-)>c(H+) | ||
| C. | a和b点溶液中:c(B-)<c(A-) | D. | b点溶液中:c(B-)+2c(OH)-=c(HB)+2c(H+) |
| A. | 浓硝酸 | B. | 氯化亚铁溶液 | C. | 工业盐酸 | D. | 溴化银 |
| 选项 | X | Y | Z |
| A | Al | NaOH(aq) | CuO(s) |
| B | Fe3O4 | HNO3(aq) | HI(aq) |
| C | Mg | NaOH(aq) | HCl(aq) |
| D | NaOH(aq) | AlCl3(aq) | HNO3(aq) |
| A. | A | B. | B | C. | C | D. | D |
 电导率可用于衡量电解质溶液导电能力大小.室温下,用0.100mol•L-lNH3•H2O滴定 10.00mL浓度均为 0.100mol•L-l HCl和CH3COOH的混合溶液,所得曲线如图所示.下列说法正确的是( )
电导率可用于衡量电解质溶液导电能力大小.室温下,用0.100mol•L-lNH3•H2O滴定 10.00mL浓度均为 0.100mol•L-l HCl和CH3COOH的混合溶液,所得曲线如图所示.下列说法正确的是( )| A. | ①点溶液中c (H+)为0.200 mol•L-l | |
| B. | 若反应容器与外界没有热交换,反应后溶液温度高低为①>③>② | |
| C. | pH的大小为:③>②>①,且③点溶液中有c(Cl-)>c(CH3COO-) | |
| D. | ③点后因离子数目减少使溶液电导率略降低 |
| A. | 丁烷 | B. | 丙酸甲酯 | C. | 丁烯 | D. | 二氯丁烷 |
 在2L的密闭容器中,高温下发生下列反应:
在2L的密闭容器中,高温下发生下列反应: