题目内容
16.电解制金属锰的阳极泥中主要含有MnO2,MnO等.利用该阳极泥生产MnO2的工艺流程如下: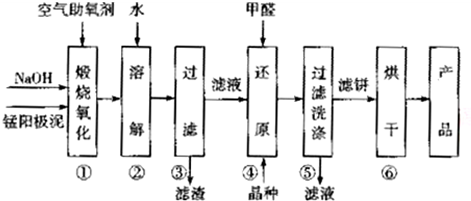
已知:①部分物质的溶解性或Ksp如表:
| 物质 | MnSO4 | Mn(OH)2 | MnO2 |
| 溶解性或Ksp | 易溶 | 1.9×10-13 | 难溶 |
回答下列问题:
(1)电解MnSO4溶液时,阴极为Mn2+得电子被还原为金属Mn,阳极反应式为2H2O-4e-=O2↑+4H+.
电解过程中溶液的pH不能过高,也不能过低,需要控制电解液的pH≈6.8,原因是pH过高,Mn2+生成Mn(OH)2,pH过低时,阴极上氢离子放电.
(2)步骤①中+2价Mn和+4价Mn均被氧化为Na2MnO4,写出该步骤中+2价Mn反应的化学方程式:MnO+2NaOH+O2$\frac{\underline{\;煅烧\;}}{\;}$Na2MnO4+H2O.
(3)步骤②一④均采用pH≈10的环境,目的是提高产品中Mn的转化率.
(4)步骤④中氧化剂与还原剂的物质的量之比为2:1,则氧化产物的化学式为CO2.该反应中除氧化产物和还原产物的另外一种生成物的化学式为NaOH.
(5)步骤⑥为烘干操作,所用的烘干设备可能是BD(填字母).
A.鼓风机 B.烘干机 C.压榨机 D.红外烘箱
(6)产率与步骤①煅烧温度的关系如图所示:
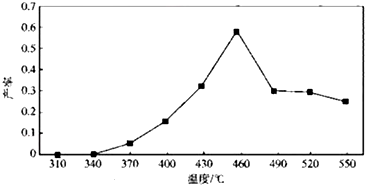
步骤①最好选用的煅烧温度约为B°C(填字母).
A.340 B.460 C.490 D.550.
分析 步骤①中+2价Mn和+4价Mn均被氧化为Na2MnO4,反应方程式分别为2MnO2+O2+4NaOH$\frac{\underline{\;煅烧\;}}{\;}$2Na2MnO4+2H2O、MnO+2NaOH+O2$\frac{\underline{\;煅烧\;}}{\;}$Na2MnO4+H2O,加入水溶解后过滤,滤液中含有NaOH和Na2MnO4,向滤液中加入甲醛,发生氧化还原反应,步骤④中氧化剂与还原剂的物质的量之比为2:1,Mn元素化合价由+6价变为+4价,该反应中Mn元素转移电子4,C元素转移电子为4时,其化合价由0价变为+4价,所以生成CO2,同时该反应中还生成NaOH;过滤洗涤得到滤饼MnO2,烘干得到产品MnO2;
(1)电解MnSO4溶液时,阴极为Mn2+得电子被还原为金属Mn,阳极上水失电子生成氧气和氢离子;
电解过程中溶液的pH过高时,Mn2+生成Mn(OH)2,pH过低时,阴极上氢离子放电;
(2)步骤①中+2价Mn被氧化为Na2MnO4,氧气被还原,二者反应生成锰酸钠和水;
(3)Na2MnO4,在PH≤7的环境中,易歧化为MnO2和高锰酸钾;
(4)步骤④中氧化剂与还原剂的物质的量之比为2:1,根据转移电子守恒知,氧化产物是二氧化碳,根据元素守恒、原子守恒知还生成另一种物质是NaOH;
(5)步骤⑥为烘干操作,所用的烘干设备可能是烘干机或核外烘箱;
(6)根据图知,340-460℃之间,随着温度的升高,产率增大,大于460℃时,升高温度产率降低.
解答 解:步骤①中+2价Mn和+4价Mn均被氧化为Na2MnO4,反应方程式分别为2MnO2+O2+4NaOH$\frac{\underline{\;煅烧\;}}{\;}$2Na2MnO4+2H2O、MnO+2NaOH+O2$\frac{\underline{\;煅烧\;}}{\;}$Na2MnO4+H2O,加入水溶解后过滤,滤液中含有NaOH和Na2MnO4,向滤液中加入甲醛,发生氧化还原反应,步骤④中氧化剂与还原剂的物质的量之比为2:1,Mn元素化合价由+6价变为+4价,该反应中Mn元素转移电子4,C元素转移电子为4时,其化合价由0价变为+4价,所以生成CO2,同时该反应中还生成NaOH;过滤洗涤得到滤饼MnO2,烘干得到产品MnO2;
(1)电解MnSO4溶液时,阴极为Mn2+得电子被还原为金属Mn,阳极上水失电子生成氧气和氢离子,电极反应式为2H2O-4e-=O2↑+4H+;
电解过程中溶液的pH过高时,Mn2+生成Mn(OH)2,pH过低时,阴极上氢离子放电,得不到MnO2,
故答案为:2H2O-4e-=O2↑+4H+;pH过高,Mn2+生成Mn(OH)2,pH过低时,阴极上氢离子放电;
(2)步骤①中+2价Mn被氧化为Na2MnO4,氧气被还原,二者反应生成锰酸钠和水,反应方程式为MnO+2NaOH+O2$\frac{\underline{\;煅烧\;}}{\;}$Na2MnO4+H2O,
故答案为:MnO+2NaOH+O2$\frac{\underline{\;煅烧\;}}{\;}$Na2MnO4+H2O;
(3)Na2MnO4,在PH≤7的环境中,易歧化为MnO2和高锰酸钾,从而降低Mn的转化率,为提高Mn的转化率,所以要控制溶液的pH为10左右,
故答案为:提高产品中Mn的转化率;
(4)向滤液中加入甲醛,发生氧化还原反应,步骤④中氧化剂与还原剂的物质的量之比为2:1,Mn元素化合价由+6价变为+4价,该反应中Mn元素转移电子4,C元素转移电子为4时,其化合价由0价变为+4价,所以生成CO2,同时该反应中还生成NaOH,
故答案为:CO2;NaOH;
(5)步骤⑥为烘干操作,所用的烘干设备可能是烘干机或核外烘箱,鼓风机和压榨机都没有烘干效果,故答案为:BD;
(6)根据图知,340-460℃之间,随着温度的升高,产率增大,大于460℃时,升高温度产率降低,所以步骤①最好选用的煅烧温度约为460°C,
故答案为:B.
点评 本题考查物质制备,为高频考点,侧重考查学生对题干信息的获取、加工、灵活应用知识解答问题能力,涉及电解原理、氧化还原法等知识点,明确元素化合物性质、物质分离提纯方法、化学反应原理等知识点是解本题关键,注意(1)题电解时离子放电顺序还与离子浓度有关,为易错点.

 阅读快车系列答案
阅读快车系列答案| A. | 铜与盐酸反应:Cu+2H+═Cu2++H2↑ | |
| B. | 氧化铁与稀盐酸反应:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 锌与硝酸银溶液反应:Zn+Ag+═Zn2++Ag | |
| D. | 在硫酸溶液中加入氢氧化钡溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
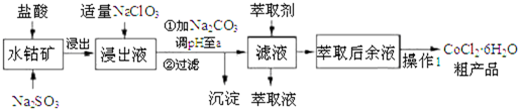
已知:①浸出液含有的阳离了主要有H+、CO2+、Fe2+、Mn2+、Al3+等:
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mo1•L-l)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+:其使用的最佳pH范围是B
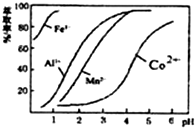
A 2.0~2.5 B 3.0~3.5 C 4.0~4.5 D 5.0~5.5
(5)“操作l”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoC12•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
 溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:NaBr+H2SO4=NaHSO4+HBr
溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:NaBr+H2SO4=NaHSO4+HBrCH3CH2OH+HBr $\stackrel{硫酸}{→}$CH3CH2Br+H2O
某课外小组欲在实验室制备溴乙烷的装置如图.数据如下表.
| 物质 数据 | 乙醇 | 溴乙烷 | 1,2-二溴乙烷 | 乙醚 | 浓硫酸 |
| 密度/g•cm-3 | 0.79 | 1.46 | 2.2 | 0.71 | 1.84 |
| 熔点(℃) | -130 | -119 | 9 | -116 | 10 |
| 沸点(℃) | 78.5 | 38.4 | 132 | 34.6 | 338 |
| 在水中的溶解度(g) | 互溶 | 0.914 | 1 | 7.5 | 互溶 |
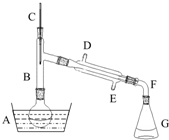
(1)加入药品之前须做的操作是检查装置的气密性.
(2)仪器B的作用是除了使溴乙烷馏出,还有一个目的是冷凝回流.温度计的温度应控制在38.4℃~78.5℃;冷却水的流向应为E进D出(填“D进E出”或“E进D出”)
(3)反应时有可能生成SO2和一种红棕色气体,可选择NaOH溶液分别除去这些气体,有关的离子方程式是SO2+2OH-=SO32-+H2O、Br2+2OH-=Br-+BrO-+H2O.
(4)实验中采用80%硫酸,而不能用98%浓硫酸,一方面是为了减少副反应(如避免HBr被氧化),另一方面是为了防止溴化氢气体的挥发.

(1)由于O2和H2O(g)的存在对该实验有不良影响,实验中应通入X气体作为保护气.在A、B、C三种仪器中反应开始前的试剂分别是:A①,B⑥,C②(填序号).
①稀硫酸 ②浓硫酸 ③稀盐酸 ④石灰石 ⑤纯碱 ⑥锌粒
(2)实验开始时,必须先通入X气体,再加热反应物,其理由是防止加热条件下H2与空气混合爆炸;
当反应引发后,移走酒精灯,反应能继续进行,其原因是Mg与SiO2的反应是放热反应.
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因用化学方程式表示为:①Mg2Si+4HCl=2MgCl2+SiH4↑,②SiH4+2O2═SiO2+2H2O.
(4)这样制得的硅会混有杂质(如SiO2等)而称粗硅,有人设计了如下流程进行提纯
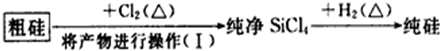
相关物质的性质如下:
| 物质 | Si | SiCl4 |
| 沸点/℃ | 2355 | 57.6 |
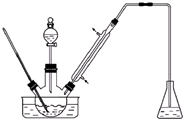 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的物理性质见附表).
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的物理性质见附表).| 相对分 子质量 | 密度 /(g•cm-3) | 沸点/℃ | |
| 溴 | 160 | 3.119 | 58.8 |
| 苯甲醛 | 106 | 1.04 | 179 |
| 1,2-二氯乙烷 | 99 | 1.2351 | 83.5 |
| 间溴苯甲醛 | 185 | 1.587 | 229 |
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛(5.3g)充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却.
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液.有机相用10%NaHCO3溶液洗涤.
步骤3:经洗涤的有机相加入适量无水硫酸钙固体,放置一段时间后过滤.
步骤4:为了防止间溴苯甲醛因温度过高被氧化,把步骤3处理得到的间溴苯甲醛加入少量锌粉,同时采用某种技术,收集相应馏分,其中收集到间溴苯甲醛为3.7g.
(1)实验装置中采用的加热方式为水浴加热,冷凝管的作用为导气、冷凝回流,锥形瓶中的试剂应为NaOH.
(2)步骤1所加入的无水AlCl3的作用为催化剂.
(3)步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的Br2、HCl(填化学式).
(4)步骤3中加入的无水硫酸钙固体的目的是除去有机相的水.
(5)步骤4中,某种技术为减压蒸馏.
(6)本实验所得到的间溴苯甲醛产率是40.0%.
| A. | 在标准状况下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol碳正离子CH5+所含的电子数为10NA | |
| C. | 56g铁粉在1mol氯气中充分燃烧,失去的电子数为3NA | |
| D. | 0.5molC3H8分子中含C-H共价键2NA |
 已知酸性高锰酸钾溶液是常用的强氧化剂,可以和草酸钠、二氧化硫等还原性物质发生氧化还原反应.
已知酸性高锰酸钾溶液是常用的强氧化剂,可以和草酸钠、二氧化硫等还原性物质发生氧化还原反应.