题目内容
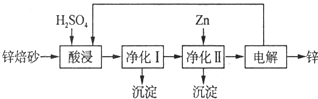
17.高铁酸钾(K2FeO4)是一种集氧化、吸附、速凝于一体的新型多功能水处理剂.其生产流程如图1: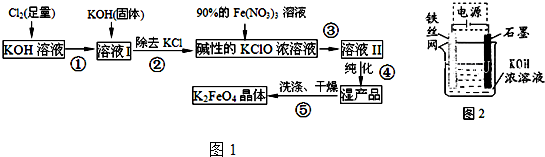
(1)配制KOH溶液时,是在每100mL水中溶解61.6g KOH固体(该溶液的密度为1.47g/mL),它的物质的量浓度是10mol/L.
(2)在溶液I中加入KOH固体的目的是AC(填编号).
A.与溶液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使副产物KClO3转化为 KClO
(3)每制得59.4克K2FeO4,理论上消耗氧化剂的物质的量为0.45mol.从溶液II中分离出K2FeO4后,还得到副产品KNO3、KCl,写出③中反应的离子方程式:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.
(4)高铁酸钾(K2FeO4)溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是4FeO42-+20 H+=4Fe3++3O2↑+10H2O.
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图2所示.电解过程中阳极的电极反应式为Fe+8OH--6e-═FeO42-+4H2O.
分析 氢氧化钾溶液中充入足量氯气,在温度较低的条件下反应生成氯化钾、次氯酸钾和水,加入氢氧化钾固体除去KCl,得到碱性KClO的浓溶液,加入90%硝酸铁溶液发生反应生成高铁酸钾溶液Ⅱ纯化得到湿产品,洗涤干燥得到K2FeO4晶体;
(1)根据n=$\frac{m}{M}$计算出氢氧化钾的物质的量,溶液质量等于溶质质量与溶剂质量之和,利用V=$\frac{m}{ρ}$计算溶液体积,再根据c=$\frac{n}{V}$计算氢氧化钾溶液的物质的量浓度;
(2)根据生产工艺流程图,第①步氯气过量,第③步需要碱性条件,在温度较高时KOH 与Cl2 反应生成的是KClO3,氧化还原反应中化合价有升有降;
(3)反应③是次氯酸根离子在碱溶液中氧化铁离子为高铁酸根离子,根据题目信息、氧化还原反应中化合价发生变化确定产物以及电子得失守恒和质量守恒来配平;
(4)向高铁酸钾溶液中滴加稀硫酸,溶液变黄色,说明生成Fe3+,并产生大量气泡,应为氧气,说明高铁酸钾在酸性条件下自身发生氧化还原反应,生成铁离子、氧气和水;
(5)阳极发生氧化反应,碱性条件下铁被氧化生成FeO42-.
解答 解:(1)61.6g KOH固体的物质的量为$\frac{61.6g}{56g/mol}$=1.1mol,溶液的质量为100mL×1g/mL+61.6g=161.6g,所以溶液的体积为$\frac{161.6g}{1.47×1{0}^{-3}g/L}$=$\frac{161.6}{1470}$L,所以氢氧化钾溶液的物质的量浓度为$\frac{1.1mol}{\frac{161.6}{1470}L}$=10mol/L,
故答案为:10;
(2)由工艺流程可知,反应液I中有过量的Cl2反应,加KOH固体的目的是与过量的Cl2继续反应,生成更多的KClO.
A、与过量的Cl2继续反应,生成更多的KClO,故A正确;
B、由信息②可知温度较高KOH与Cl2 反应生成的是KClO3,不利用KClO生成、浪费原料,故B错误;
C、由工艺流程及③可知,利用Fe(NO3)3与KClO制备K2FeO4,故C正确;
D、由信息可知,该条件下KClO3 不能转化为KClO,故D错误.
故选:AC;
(3)据题目信息和氧化还原反应中化合价发生变化确定找出反应物:Fe3+、ClO-,生成物:FeO42-、Cl-,根据电子得失守恒和质量守恒来配平,可得③中反应的离子方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.
每制得59.4克K2FeO4,物质的量=$\frac{59.4g}{198g/mol}$=0.3mol,理论上消耗氧化剂为KClO的物质的量 依据离子方程式定量关系计算,
2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
3 2
n 0.3mol
n=0.45mol
故答案为:0.45;2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(4)向高铁酸钾溶液中滴加稀硫酸,溶液变黄色,说明生成Fe3+,并产生大量气泡,应为氧气,反应的离子方程式为4FeO42-+20 H+=4Fe3++3O2↑+10H2O,说明高铁酸钾在酸性条件下自身发生氧化还原反应,
故答案为:4FeO42-+20 H+=4Fe3++3O2↑+10H2O;
(5)阳极发生氧化反应,碱性条件下铁被氧化生成FeO42-,电极方程式为Fe+8OH--6e-═FeO42-+4H2O,故答案为:Fe+8OH--6e-═FeO42-+4H2O.
点评 本题结合高铁酸钾(K2FeO4)的制备主要考查了氧化还原反应的知识、离子的检验等,为高考常见题型,题目培养了学生运用知识的能力.侧重考查物质制备与物质分离提纯的分析判断,实验过程的理解应用和基本操作的分析应用,题目难度中等.

 阅读快车系列答案
阅读快车系列答案
(1)由于O2和H2O(g)的存在对该实验有不良影响,实验中应通入X气体作为保护气.在A、B、C三种仪器中反应开始前的试剂分别是:A①,B⑥,C②(填序号).
①稀硫酸 ②浓硫酸 ③稀盐酸 ④石灰石 ⑤纯碱 ⑥锌粒
(2)实验开始时,必须先通入X气体,再加热反应物,其理由是防止加热条件下H2与空气混合爆炸;
当反应引发后,移走酒精灯,反应能继续进行,其原因是Mg与SiO2的反应是放热反应.
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因用化学方程式表示为:①Mg2Si+4HCl=2MgCl2+SiH4↑,②SiH4+2O2═SiO2+2H2O.
(4)这样制得的硅会混有杂质(如SiO2等)而称粗硅,有人设计了如下流程进行提纯
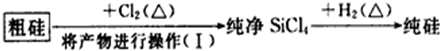
相关物质的性质如下:
| 物质 | Si | SiCl4 |
| 沸点/℃ | 2355 | 57.6 |
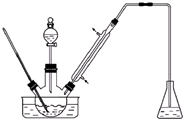 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的物理性质见附表).
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的物理性质见附表).| 相对分 子质量 | 密度 /(g•cm-3) | 沸点/℃ | |
| 溴 | 160 | 3.119 | 58.8 |
| 苯甲醛 | 106 | 1.04 | 179 |
| 1,2-二氯乙烷 | 99 | 1.2351 | 83.5 |
| 间溴苯甲醛 | 185 | 1.587 | 229 |
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛(5.3g)充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却.
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液.有机相用10%NaHCO3溶液洗涤.
步骤3:经洗涤的有机相加入适量无水硫酸钙固体,放置一段时间后过滤.
步骤4:为了防止间溴苯甲醛因温度过高被氧化,把步骤3处理得到的间溴苯甲醛加入少量锌粉,同时采用某种技术,收集相应馏分,其中收集到间溴苯甲醛为3.7g.
(1)实验装置中采用的加热方式为水浴加热,冷凝管的作用为导气、冷凝回流,锥形瓶中的试剂应为NaOH.
(2)步骤1所加入的无水AlCl3的作用为催化剂.
(3)步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的Br2、HCl(填化学式).
(4)步骤3中加入的无水硫酸钙固体的目的是除去有机相的水.
(5)步骤4中,某种技术为减压蒸馏.
(6)本实验所得到的间溴苯甲醛产率是40.0%.
 某同学用0.1082mol/L的NaOH溶液滴定未知浓度的盐酸.
某同学用0.1082mol/L的NaOH溶液滴定未知浓度的盐酸.以下是实验数据记录表:
| 实验序号 | 待测盐酸溶液体积(mL) | 滴定管读数 | 消耗标准NaOH溶液的体积(mL) | |
| 初读数 | 末读数 | |||
| 1 | 20.00 | 0.00 | 19.90 | 19.90 |
| 2 | 20.00 | 0.05 | ||
(2)计算待测盐酸溶液浓度.
| A. | 在标准状况下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol碳正离子CH5+所含的电子数为10NA | |
| C. | 56g铁粉在1mol氯气中充分燃烧,失去的电子数为3NA | |
| D. | 0.5molC3H8分子中含C-H共价键2NA |
| A. |  | B. |  | C. |  | D. |  |
 ;
;