题目内容
14.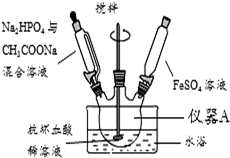 磷酸亚铁[Fe3(PO4)2•8H2O]为白蓝色晶体,溶于强酸,不溶于水、醋酸和乙醇.主要用于制造磷酸铁锂电池.实验室制备磷酸亚铁的装置示意图如图、反应和实验步骤如下.
磷酸亚铁[Fe3(PO4)2•8H2O]为白蓝色晶体,溶于强酸,不溶于水、醋酸和乙醇.主要用于制造磷酸铁锂电池.实验室制备磷酸亚铁的装置示意图如图、反应和实验步骤如下.主要反应为:
3FeSO4+2Na2HPO4+2CH3COONa+8H2O=Fe3(PO4)2•8H2O↓+3Na2SO4+2CH3COOH
实验步骤:①在仪器A中先加入抗坏血酸(C6H8O6)稀溶液作底液②向仪器A中,滴入Na2HPO4与CH3COONa混合溶液至pH=4 ③滴入15.2克FeSO4溶液,最终维持pH=6,充分反应后,静置④进行操作a,干燥得到的磷酸亚铁12.8克.
(1)仪器A的名称是三颈烧瓶.
(2)实验中配制FeSO4溶液时,先要对蒸馏水进行的操作是煮沸、冷却.
(3)实验中不是将三种溶液直接混合的原因是避免生成Fe(OH)2沉淀,反应时需不断搅拌,其目的是使反应物充分接触,避免生成Fe(OH)2沉淀 .
(4)步骤④进行的操作a是过滤、洗涤.
(5)检验磷酸亚铁粗产品中是否混有氢氧化铁杂质的方法是取少量固体溶于适量盐酸,然后滴入KSCN溶液,容易变红色,说明含有Fe3+,否则不含.
(6)本实验的产率是76.5%.
分析 (1)仪器a为三颈烧瓶;
(2)配制溶液时加热抗坏血酸,防止Fe2+离子被氧化,蒸馏水事先要煮沸除去溶液中的溶解的氧气;
(2)分别加入药品,混合溶液至pH=4时,再加入FeSO4溶液,防止生成Fe(OH)2沉淀;制备时需不断搅拌,使反应物充分接触,也会防止生成Fe(OH)2沉淀;
(3)生成的Fe3(PO4)2•8H2O 固体混有杂质SO42-离子,通过检验SO42-,判断沉淀洗涤干净与否;
(4)步骤是分离不溶的固体与液体得到磷酸亚铁粗产品,需要采取过滤、洗涤等;
(5)用盐酸溶解,再用KSCN溶液检验Fe3+;
(6)根据Fe原子守恒计算Fe3(PO4)2•8H2O的理论产量,进而计算产率.
解答 解:(1)由仪器结构特征,可知仪器a为三颈烧瓶,
故答案为:三颈烧瓶;
(2)Fe2+具有强还原性,配制溶液时加热抗坏血酸,防止Fe2+离子被氧化,蒸馏水事先要煮沸、冷却,可以除去溶液中的溶解的氧气,避免氧化Fe2+;
故答案为:煮沸、冷却;
(3)Na2HPO4与CH3COONa混合溶液呈碱性,直接混合容易产生成Fe(OH)2沉淀,实验时三种溶液分别加入,混合溶液至pH=4时,再加入FeSO4溶液,防止生成Fe(OH)2沉淀;
制备时需不断搅拌,使反应物充分接触,也会防止生成Fe(OH)2沉淀;
故答案为:避免生成Fe(OH)2沉淀;使反应物充分接触,避免生成Fe(OH)2沉淀;
(4)步骤是分离不溶的固体与液体得到磷酸亚铁粗产品,需要采取过滤、洗涤等,
故答案为:过滤、洗涤;
(5)检验磷酸亚铁粗产品中是否有Fe(OH)3杂质的方法是:取少量固体溶于适量盐酸,然后滴入KSCN溶液,容易变红色,说明含有Fe3+,否则不含,
故答案为:取少量固体溶于适量盐酸,然后滴入KSCN溶液,容易变红色,说明含有Fe3+,否则不含;
(6)15.2gFeSO4的物质的量为$\frac{15.2g}{152g/mol}$=0.1mol,根据Fe元素守恒,理论上得到Fe3(PO4)2•8H2O的质量为0.1mol×$\frac{1}{3}$×502g/mol=16.73g,磷酸亚铁产率是$\frac{12.8g}{16.73g}$×100%=76.5%,
故答案为:76.5%.
点评 本题考查物质制备实验方案,涉及对仪器识别、物质的分离提纯、对操作的分析评价、实验方案设计、产率计算等,较好的考查学生信息获取与知识迁移运用能力,题目难度中等.

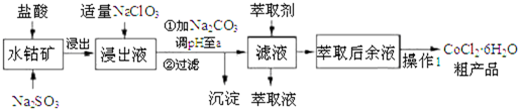
已知:①浸出液含有的阳离了主要有H+、CO2+、Fe2+、Mn2+、Al3+等:
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mo1•L-l)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+:其使用的最佳pH范围是B
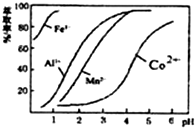
A 2.0~2.5 B 3.0~3.5 C 4.0~4.5 D 5.0~5.5
(5)“操作l”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoC12•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
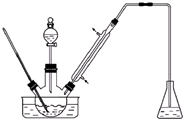 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的物理性质见附表).
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的物理性质见附表).| 相对分 子质量 | 密度 /(g•cm-3) | 沸点/℃ | |
| 溴 | 160 | 3.119 | 58.8 |
| 苯甲醛 | 106 | 1.04 | 179 |
| 1,2-二氯乙烷 | 99 | 1.2351 | 83.5 |
| 间溴苯甲醛 | 185 | 1.587 | 229 |
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛(5.3g)充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却.
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液.有机相用10%NaHCO3溶液洗涤.
步骤3:经洗涤的有机相加入适量无水硫酸钙固体,放置一段时间后过滤.
步骤4:为了防止间溴苯甲醛因温度过高被氧化,把步骤3处理得到的间溴苯甲醛加入少量锌粉,同时采用某种技术,收集相应馏分,其中收集到间溴苯甲醛为3.7g.
(1)实验装置中采用的加热方式为水浴加热,冷凝管的作用为导气、冷凝回流,锥形瓶中的试剂应为NaOH.
(2)步骤1所加入的无水AlCl3的作用为催化剂.
(3)步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的Br2、HCl(填化学式).
(4)步骤3中加入的无水硫酸钙固体的目的是除去有机相的水.
(5)步骤4中,某种技术为减压蒸馏.
(6)本实验所得到的间溴苯甲醛产率是40.0%.
 某同学用0.1082mol/L的NaOH溶液滴定未知浓度的盐酸.
某同学用0.1082mol/L的NaOH溶液滴定未知浓度的盐酸.以下是实验数据记录表:
| 实验序号 | 待测盐酸溶液体积(mL) | 滴定管读数 | 消耗标准NaOH溶液的体积(mL) | |
| 初读数 | 末读数 | |||
| 1 | 20.00 | 0.00 | 19.90 | 19.90 |
| 2 | 20.00 | 0.05 | ||
(2)计算待测盐酸溶液浓度.
| A. | 酸式滴定管未用待测溶液润洗 | |
| B. | 碱式滴定管未用待装溶液润洗 | |
| C. | 锥形瓶未用待装溶液润洗 | |
| D. | 在滴定前滴定管尖嘴部分有气泡,滴定后气泡消失 |
| A. | 在标准状况下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol碳正离子CH5+所含的电子数为10NA | |
| C. | 56g铁粉在1mol氯气中充分燃烧,失去的电子数为3NA | |
| D. | 0.5molC3H8分子中含C-H共价键2NA |
| A. | 已知X、Y元素同周期,且电负性X>Y,则第一电离能X大于Y | |
| B. | 分子中键能越大,键长越短,则分子越稳定,熔沸点越高 | |
| C. | N-H键键能的含义是拆开约6.02×1023个N-H键所吸收的能量 | |
| D. | H2O中每个O原子结合2个H原子的根本原因是共价键具有方向性 |
| A. | O、S、Na | B. | Mg、P、Cl | C. | Cl、Na、F | D. | S、N、C |