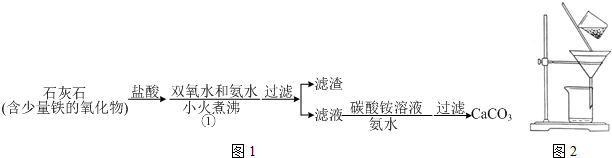
题目内容
4.乙酸乙酯是无色具有水果香味的液体,沸点77.2℃,某同学制取它用醋酸14.3mL,95%的乙醇 23mL,还用到浓硫酸、饱和碳酸钠溶液.主要仪器如图所示.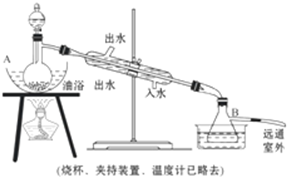
实验步骤是:
①先向A中蒸馏烧瓶注入乙醇,然后加入浓硫酸摇匀,再将醋酸注入分液漏斗里待用.这时分液漏斗里乙醇与乙酸的物质的量之比约为7:5.
②加热油浴保持温度约135℃~145℃.
③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加料速度使蒸出酯的速度与进料速度大体相等,直到加料完全.
④保持油浴温度一段时间,至不再有液体流出后,停止加热.
⑤取下B中的锥形瓶,将一定量饱和Na2CO3溶液分批、少量、多次地加到馏出液里,边加边摇荡,至无气泡产生为止.
⑥将⑤的液体混合物分液,弃去水层.
⑦分液漏斗里得到的是初步提纯的乙酸乙酯粗品.
试回答:
(1)乙醇和乙酸中所含官能团的名称分别为羟基和羧基.
(2)实验中浓硫酸的主要作用是催化剂、吸水剂.
(3)用过量乙醇的主要目的是促进乙酸转化,利用合成乙酸乙酯.
(4)实验中用油浴加热的优点是保持温度恒定.
(5)制取乙酸乙酯的反应类型是酯化反应,反应方程式为CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O.
(6)用饱和Na2CO3溶液洗涤粗酯的目的是吸收乙醇、除去乙酸,降低乙酸乙酯的溶解度.如果用NaOH浓溶液代替Na2CO3溶液将引起的后果是酯发生水解.
分析 (1)乙醇含-OH,乙酸含-COOH;
(2)酯化反应为可逆反应,且浓硫酸具有吸水性;
(3)过量乙醇,可促进乙酸的转化;
(4)加热油浴保持温度约135℃~145℃,温度恒定;
(5)乙酸与乙醇发生酯化反应生成乙酸乙酯和水,醇脱H,羧酸脱羟基;
(6)饱和碳酸钠溶液可吸收乙醇、除去乙酸,降低乙酸乙酯的溶解度,乙酸乙酯与碳酸钠溶液分层;乙酸乙酯与NaOH发生水解反应.
解答 解:(1)乙醇和乙酸中所含官能团的名称分别为羟基和羧基,故答案为:羟基;羧基;
(2)实验中浓硫酸的主要作用是催化剂、吸水剂,故答案为:催化剂、吸水剂;
(3)用过量乙醇的主要目的是促进乙酸转化,利用合成乙酸乙酯,故答案为:促进乙酸转化,利用合成乙酸乙酯;
(4)实验中用油浴加热的优点是保持温度恒定,故答案为:保持温度恒定;
(5)制取乙酸乙酯的反应类型是酯化反应,反应方程式为CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,
故答案为:酯化;CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O;
(6)用饱和Na2CO3溶液洗涤粗酯的目的是吸收乙醇、除去乙酸,降低乙酸乙酯的溶解度.如果用NaOH浓溶液代替Na2CO3溶液将引起的后果是酯发生水解,
故答案为:吸收乙醇、除去乙酸,降低乙酸乙酯的溶解度;酯发生水解.
点评 本题考查有机物的制备实验,为高频考点,把握物质的制备原理、性质、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意有机物的性质及应用,题目难度不大.

练习册系列答案
相关题目
16.化学兴趣小组的同学设计实验探究浓硫酸与木炭反应后产生气体的成分.
(1)写出浓硫酸与木炭反应方程式,并标明电子转移的方向和数目: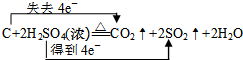 .
.
【装置设计】组装如下的实验装置,然后进行实验探究.
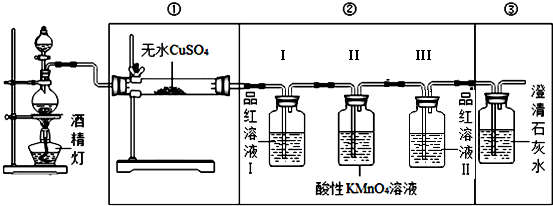
(2)装入反应物之前,必须先检验装置气密性.
【实验探究】
(3)观察实验,完成实验现象的部分记录:
(4)实验装置②中品红溶液Ⅰ的作用验证烧瓶中有SO2,品红溶液Ⅱ的作用作用确认SO2除尽.
(1)写出浓硫酸与木炭反应方程式,并标明电子转移的方向和数目:
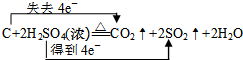 .
.【装置设计】组装如下的实验装置,然后进行实验探究.

(2)装入反应物之前,必须先检验装置气密性.
【实验探究】
(3)观察实验,完成实验现象的部分记录:
| 实验装置 | ① | ③ |
| 实验现象 |
17.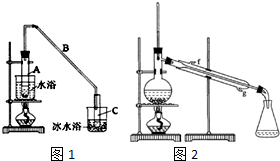 某化学小组采用类似乙酸乙酯的装置如图1:以环己醇制备环己烯.
某化学小组采用类似乙酸乙酯的装置如图1:以环己醇制备环己烯.
已知: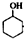 $→_{85℃}^{稀H_{2}SO_{4}}$
$→_{85℃}^{稀H_{2}SO_{4}}$ +H2O
+H2O
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是,导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是进一步冷却,防止环己烯挥发.
③浓H2SO4在反应中的作用催化剂、脱水剂.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入蒸馏水,振荡、静置、分层,环己烯在上 层(填上或下).
②再将环己烯按图2装置蒸馏,冷却水从g (填入编号)口进入.蒸馏时要加入生石灰的目的除去了残留的水.
(3)以下可以鉴别环己烯和环己醇的物质有bc.
a.用酸性高锰酸钾溶液 b.用金属钠 c.溴水.
 某化学小组采用类似乙酸乙酯的装置如图1:以环己醇制备环己烯.
某化学小组采用类似乙酸乙酯的装置如图1:以环己醇制备环己烯.已知:
 $→_{85℃}^{稀H_{2}SO_{4}}$
$→_{85℃}^{稀H_{2}SO_{4}}$ +H2O
+H2O| 密度(g.cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.096 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.081 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是,导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是进一步冷却,防止环己烯挥发.
③浓H2SO4在反应中的作用催化剂、脱水剂.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入蒸馏水,振荡、静置、分层,环己烯在上 层(填上或下).
②再将环己烯按图2装置蒸馏,冷却水从g (填入编号)口进入.蒸馏时要加入生石灰的目的除去了残留的水.
(3)以下可以鉴别环己烯和环己醇的物质有bc.
a.用酸性高锰酸钾溶液 b.用金属钠 c.溴水.
8.下列各反应达到化学平衡后,加压或降温都能使化学平衡向逆反应方向移动的是( )
| A. | 2NO2 (g)?N2O4(g)△H<0 | B. | C(s)+CO2 (g)?2CO(g)△H>0 | ||
| C. | N2(g)+3H2 (g)?2NH3(g)△H<0 | D. | H2S (g)?H2 (g)+S(s)△H>0 |
15.已知图一表示的是可逆反应CO(g)+H2(g)?C(s)+H2O(g)△H>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应N2O4(g)?2NO2(g)△H>0的浓度(c)随时间(t)的变化情况.下列说法中正确的是( )
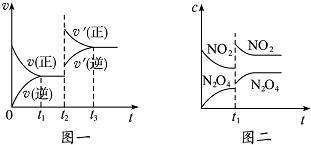

| A. | 图一t2时改变的条件可能是升高了温度或增大了压强 | |
| B. | 图一t2时改变的条件是增大压强,则反应的△H增大 | |
| C. | 图二t1时改变的条件可能是升高了温度 | |
| D. | 若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将增大 |
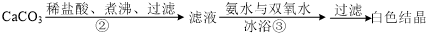
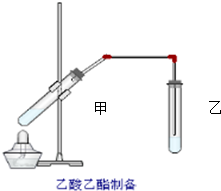 如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:
如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答: